题目内容
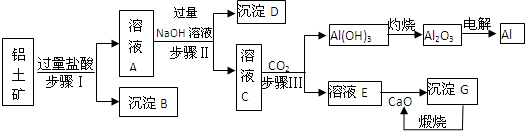
9.金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4.它是空间技术、航海、化工、医疗上不可缺少的材料.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图(部分产物略去):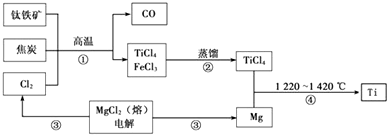
(1)步骤①反应的化学方程式为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,还 原剂是FeTiO3、C,每生成1mol TiCl4转移7mol电子.
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3沸点的不同.
(3)步骤④反应的化学方程式为Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$MgCl2+Ti,该反应在氩气中进行的理由是防止Mg、Ti被氧化.
(4)绿色化学提倡物料循环.以上流程中,可用于循环的物质除Cl2、Mg外,还有MgCl2.
分析 本题是工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程,考查了氧化还原反应的分析,还原剂在反应中失电子,所含元素化合价升高,电子转移数目的分析可根据化合价的变化数值来判断,根据TiCl4与FeCl3的沸点差异可通过加热蒸馏进行分离,因镁易氧化,反应④要在无氧条件下进行,防止镁被氧化,可通过反应过程中得到的副产物及反应需要添加的物质来判断需要循环利用的物质;
(1)2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO中C的化合价由0升高到+2价、FeTiO3中铁由+2价升高到+3,均被氧化,每生成1mol TiCl4,同时参加反应反应的Cl2为3.5mol,即可计算出转移电子总数;
(2)TiCl4与FeCl3两者沸点不同,可通过蒸馏进行分离;
(3)步骤④是Mg和TiCl4在无氧的条件下进行,生成MgCl2和Ti,无氧环境有氩气提供;
(4)整个流程中的副产品共有Cl2、Mg、MgCl2、CO及FeCl3,其中Cl2、Mg和MgCl2都是流程中参加反应的反应物;
解答 解:(1)结合氧化还原的分析可知,C和FeTiO3所含元素化合价升高,是还原剂,氯气是氧化剂,当生成1mol TiCl4时,被还原的Cl2为3.5mol,转移电子的物质的量为3.5mol×2=7mol,故答案为:FeTiO3、C;7;
(2)可以通过加热蒸馏的方式分离TiCl4与FeCl3的混合物,说明两者存在沸点差异,故答案为:沸点;
(3)步骤④Mg和TiCl4生成MgCl2和Ti,反应的方程式为Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$MgCl2+Ti,选择在氩气中进行,是防止镁及钛与氧气发生氧化反应,故答案为:Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$MgCl2+Ti;防止Mg、Ti被氧化;
(4)步骤④生成的可用于电解MgCl2得到镁和氯气,可循环利用,故答案为:MgCl2.
点评 考查氧化还原反应的分析及金属的冶炼,注重反应原理的考查,中等难度.

| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
已知:
 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$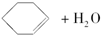

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止液体暴沸,②导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g(填g或f)口进入.蒸馏时要加入生石灰,目的是除去环己烯中少量的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出.
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| B. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的 $\frac{1}{2}$,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% |
| A. | 室温时将pH=5的盐酸稀释100倍所得到的溶液 | |
| B. | 等物质的量的强酸和强碱反应后所得到的混合溶液 | |
| C. | 氢氧化钠溶液与醋酸溶液混合后c(Na+)=c(CH3COO-)的溶液 | |
| D. | 硝酸铵溶于水得到的溶液 |