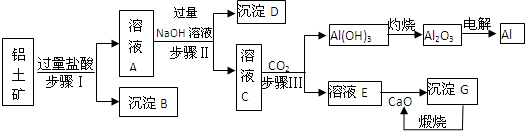
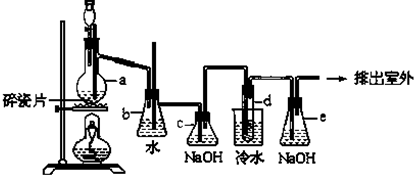
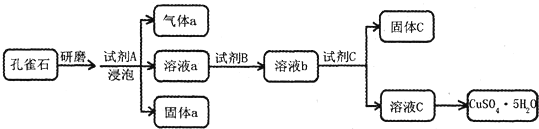
题目内容
12.(氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图1: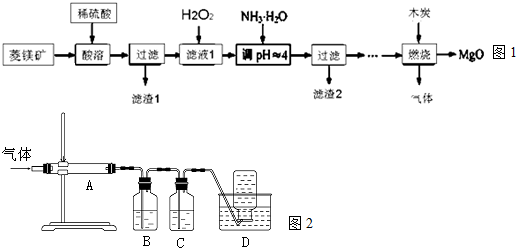
(1)稀硫酸与MgCO3反应的离子方程式为MgCO3+2H+═Mg2++CO2↑+H2O.
(2)加入H2O2的作用是将亚铁离子氧化为铁离子,发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,调溶液pH≈4目的是使Fe(OH)3生成沉淀.
(3)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用图2装置对煅烧产生的气体进行分步吸收或收集.
①B中盛放的溶液可以是d(填字母).B中的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++4H++5SO42-.
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
②D中收集的气体可以是CO(填化学式).
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,该反应中氧化剂与
还原剂的物质的量比2:1.
分析 制备高纯氧化镁的实验流程:菱镁矿(主要成分为MgCO3,含少量FeCO3)加入酸溶解,过滤得到溶液中含有亚铁离子和镁离子,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入一水合氨调节溶液PH为4,使铁离子全部沉淀,过滤得到滤渣2为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤制备硫酸镁,硫酸镁与木炭煅烧得到MgO.
(1)碳酸镁与稀硫酸反应生成硫酸镁水和二氧化碳;
(2)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁;加入氨水调节溶液PH使氢氧化铁全部沉淀;
(3)煅烧时应用坩埚加热固体;煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.
①二氧化硫中+4价的硫具有还原性,高锰酸钾中+7价的锰具有氧化性,两者发生氧化还原反应生成+2价的锰、+6价的硫,据此书写方程式;
②D中收集的气体是CO;
③氧化还原反应中化合价降低的物质为氧化剂,化合价升高的物质为还原剂,该反应中氧化剂、还原剂都为S,根据得失电子求解氧化剂与还原剂的物质的量比.
解答 解:(1)MgCO3与稀硫酸反应生成硫酸镁、二氧化碳和水,反应的离子方程式为MgCO3+2H+═Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水调溶液pH≈4,使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:将亚铁离子氧化为铁离子;2Fe2++H2O2+2H+=2Fe3++2H2O;Fe(OH)3;
(3)①B中盛放的溶液可以KMnO4溶液吸收二氧化硫,反应为5SO2+2KMnO4+2H2O═K2SO4 +2MnSO4+2H2SO4,反应离子方程式为:5SO2+2MnO4-+2H2O═2Mn2++4H++5SO42-,
故答案为:d;
②B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集,
故答案为:CO;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O,
该反应中氧化剂为S(2个硫从0→-2),还原剂为S(1个硫从0→+4),两者的物质的量比为2:1,
故答案为:2:1.
点评 本题考查了镁、铁及其化合物、二氧化硫性质应用,混合物分离方法和实验操作方法、氧化还原反应的计算,物质性质熟练掌握是解题关键,题目难度中等.

| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
 Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.
Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.