题目内容
12.氨在国防、工农业等领域发挥着重要作用.(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
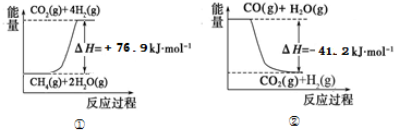
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
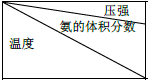 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
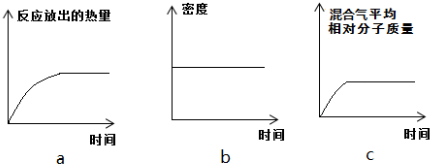
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
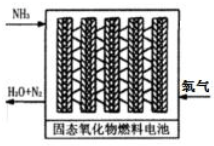
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
分析 (1)据图分析,反应①的反应物能量低于生成物,反应吸热,热化学方程式为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+76.9KJ/mol,反应②反应物能量高于生成物,反应放热,热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2KJ/mol,结合盖斯定律书写CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式;
(2)该反应是反应是气体体积减小的放热反应,依据平衡移动方向分析判断需要的条件;
Ⅰ、根据表中数据分析,相同温度时,氨气体积分数随压强变化和相同压强时氨气体积分数随温度变化即定一议二原则分析;
Ⅱ、恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol,反应放热,随反应减小速率减慢,放热减少,容器体积不变,混合气体密度不变,反应正向进行,混合气体质量不变,总物质的量减少,混合气体的平均相对分子质量增大,但开始不为0,据此分析;
(3)负极发生氧化反应,氨气被氧化生产氮气,氧气被还原生成水,据电子守恒计算需要氨气体积,此解答即可.
解答 解:(1)据图热化学方程式为:①CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+76.9KJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2KJ/mol,据盖斯定律①-②得:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol,故答案为:吸热;CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol;
(2)吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压;
故答案为:b;
Ⅰ、依据定一议二原则,温度相同时,氨气体积分数随压强的增大而增大,说明加压平衡正向移动,压强相同时,氨气体积分数随温度的升高而减小,说明升温平衡逆向移动,正反应放热,故答案为:氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应;
Ⅱ、恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol,反应放热,随反应减小速率减慢,放热减少,容器体积不变,混合气体密度不变,反应正向进行,混合气体质量不变,总物质的量减少,混合气体的平均相对分子质量增大,但开始不为0,故答案为:ab;
(3)①负极发生氧化反应,氨气被氧化生产氮气,氧气被还原,电解质为固态氧化物说明氧气被还原为氧离子,负极的电极反应式为:2NH3-6e-+3O2-=N2+3H2O,故答案为:2NH3-6e-+3O2-=N2+3H2O;
②电解300moL的饱和食盐水,一段时间后,溶液pH为13,生成n(OH-)=0.3L×0.1mol/L=0.03mol,据电解方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,每生成2molNaOH,转移2mol电子,所以转移电子物质的量为0.03mol,结合2NH3-6e-+3O2-=N2+3H2O,需要反应氨气0.01mol,标准状况下体积为0.224L,故答案为:0.224.
点评 本题考查了盖斯定律的应用、工业生产条件选择、平衡移动、电极反应式书写、电化学计算,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 苯酚溶液不慎沾到皮肤上,立即用酒精溶液洗涤 | |
| B. | 任何条件下,稻草不可能转变为葡萄糖或酒精 | |
| C. | 氯化汞(HgCl2)的稀溶液不可用于手术器械消毒,因为它会使人体蛋白质变性 | |
| D. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
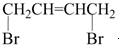 可经三步反应制取
可经三步反应制取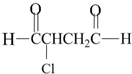 ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A. | 水解反应、加成反应、氧化反应 | B. | 加成反应、水解反应、氧化反应 | ||
| C. | 水解反应、氧化反应、加成反应 | D. | 加成反应、氧化反应、水解反应 |
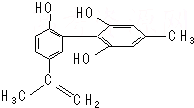 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
| A. | 甲烷 | B. | 乙醇 | C. | 苯 | D. | 乙酸乙酯 |
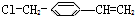 推测它不可能具有下列哪种性质( )
推测它不可能具有下列哪种性质( )| A. | 能被酸性高锰酸钾溶液氧化 | B. | 能使溴水发生加成反应而褪色 | ||
| C. | 能发生水解反应 | D. | 易溶于水,也易溶于有机溶剂 |