题目内容
2.有一种有机物结构简式为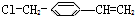 推测它不可能具有下列哪种性质( )
推测它不可能具有下列哪种性质( )| A. | 能被酸性高锰酸钾溶液氧化 | B. | 能使溴水发生加成反应而褪色 | ||
| C. | 能发生水解反应 | D. | 易溶于水,也易溶于有机溶剂 |
分析 该分子中含有氯原子、碳碳双键和苯环,具有氯代烃、烯烃、苯的性质,能发生取代反应、水解反应、氧化反应、加成反应、还原反应、加聚反应,据此分析解答.
解答 解:A.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化生成-COOH,故A不选;
B.含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故B不选;
C.含有氯原子,能发生水解反应生成-CH2OH,故C不选;
D.不含亲水基,只含憎水基,所以不易溶于水,根据相似相溶原理知,易溶于有机溶剂,故D选;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查卤代烃、烯烃性质,注意:即使不含碳碳双键,如果苯环上连接-CH2CH3也能被酸性高锰酸钾溶液氧化,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
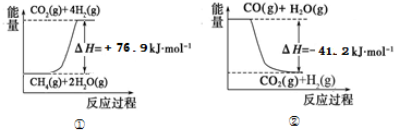
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应.
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
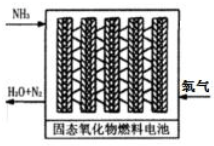
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示

反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
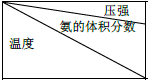 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).

(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:

①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
10.23Na与23Na+比较,相同的是( )
| A. | 微粒半径 | B. | 化学性质 | C. | 最外层电子数 | D. | 质子数 |
17.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1 mol的氢氧根离子所含电子数均为9 NA | |
| B. | 1.00 mol NaCl中含有NA个NaCl分子 | |
| C. | 常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
7.已知下列元素的原子半径:
根据以上数据,磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
14.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
14.以铅蓄电池为电源电解强酸性的CO2水溶液可以得到丙烯,a和b为特殊惰性电极,原理如甲、乙两图所示.下列有关说法正确的是( )
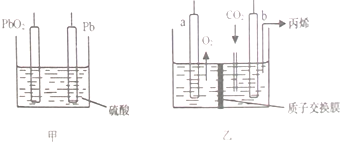

| A. | 为实现工作原理,PbO2电极应与b电极相连 | |
| B. | b电极反应式为:3CO2+18e-+18H+=6H2O+CH3CH=CH2 | |
| C. | 在铅蓄电池供电过程中,Pb电极质量不断减小 | |
| D. | 乙装置中H+由b电极向a电极移动 |