题目内容
2.Ⅰ.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的某性质)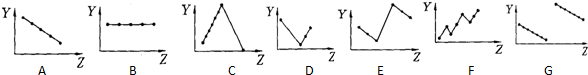
将上面有关元素性质的曲线标号填入相应元素性质后面的括号中:
(1)ⅡA族元素的最外层电子数B
(2)第三周期元素的最高化合价C
(3)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径E
(4)第二、三周期元素随原子序数递增原子半径的变化(不包括惰性气体)G
(5)碱金属的阳离子氧化能力(不包括钫)A
Ⅱ.如图是元素周期表的一部分
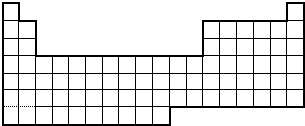
(1)请在表中画出金属与非金属的交界线
(2)请在表中用阴影标出第 VIII族的位置
(3)在表中标出${\;}_{22}^{48}$Ti的位置.
分析 Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束.
(3)电子层结构相同,核电荷数越大,离子半径越小,最外层电子数相同,电子层越多,离子半径越大.
(4)同周期主族元素,随原子序数递增原子半径减小.
(5)碱金属,随核电荷数增大,单质的还原性增强,阳离子的氧化性减弱.
II、(1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第IIIB族.
解答 解:Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变,故图B符合.
故选:B.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束,故图C符合.
故选:C.
(3)电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图E符合.
故选:E.
(4)同周期主族元素,随原子序数递增原子半径减小,故图G符合.
故选:G.
(5)碱金属,随核电荷数增大,单质的还原性增强,阳离子的氧化性减弱,故图A符合.
故选:A.
II、(1)最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属性元素;
(2)第VⅢ位于周期表第8、9、10纵行;
(3)Ti位于第四周期第ⅢB族,即第四周期第3纵行;
则画出图象为: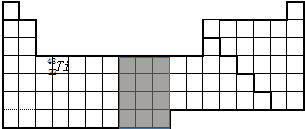 ;
;
故答案为: .
.
点评 本题考查元素周期律、原子结构与性质递变规律、元素周期表的结构等,难度不大,注意规律的归纳与总结与理解.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | 聚丙烯的结构简式为: | B. | 氯化氢的电子式为: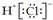 | ||
| C. | 甲烷的比例模型: | D. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl |

下列说法正确的是( )
| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是KOH(填化学式),最高价氧化物的水化物酸性最强的是HClO4(填化学式).
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是HF(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):Na+<F-<Cl-
(5)写出③和⑨形成的化合物的电子式:
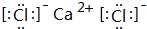 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”). | A. | 氯原子的结构示意图: | B. | 氯化铵的电子式: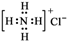 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |

| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
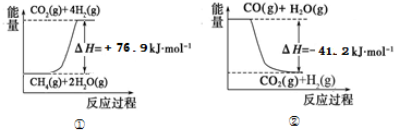
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
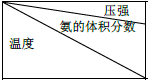 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
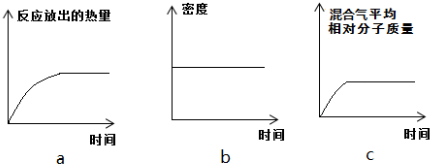
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
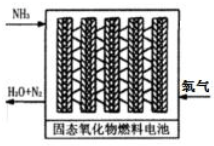
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
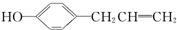
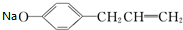 +H2O;
+H2O;