题目内容
4.在常温常压下,等物质的量的下列物质完全燃烧,消耗氧气最多的是( )| A. | 甲烷 | B. | 乙醇 | C. | 苯 | D. | 乙酸乙酯 |
分析 设烃的化学式为CxHy,燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2 $\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,等物质的量的烃完全燃烧耗氧量由x+$\frac{y}{4}$值决定,x+$\frac{y}{4}$的值越大,消耗氧气的量就越多;可拆成形式为CxHy•(CO2)m•(H2O)n的烃的衍生物完全燃烧后,消耗的O2的量由x+$\frac{y}{4}$值决定,x+$\frac{y}{4}$值越大,消耗氧气的量就越多.
解答 解:设物质的物质的量都为1mol,
A、甲烷CH4燃烧消耗的氧气的物质的量为(1+$\frac{4}{4}$)mol=2mol,
B、C2H6O可拆写成C2H4•H2O,消耗的氧气的物质的量为(2+$\frac{4}{4}$)mol=3mol,
C、苯C6H6燃烧消耗的氧气的物质的量为(6+$\frac{6}{4}$)mol=7.5mol,
D、乙酸乙酯C4H8O2可拆写成C4H4•2H2O,消耗的氧气的物质的量(4+$\frac{4}{4}$)mol=5mol,
所以消耗氧气最多的是C6H6,
故选:C.
点评 本题考查有机物耗氧量的计算,题目难度中等,注意利用分子式的变形较为直观,可以省去书写化学方程式的繁琐.

练习册系列答案
相关题目
14.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: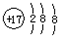 | B. | 氯化铵的电子式: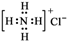 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
15.下列物质既能与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 碳酸氢铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
12.氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
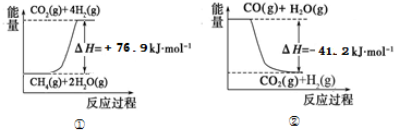
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应.
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
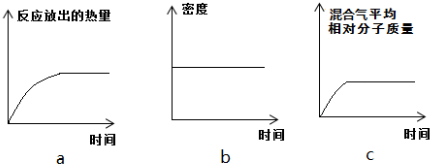
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示

反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
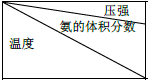 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).

(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:

①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
19.下列说法错误的是( )
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
16.根据表中维生素C的有关信息,回答下列问题
(1)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是苹果、西红柿;
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
14.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| B. | 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |