题目内容
3.下列叙述与蛋白质或糖类物质性质有关,并正确的是( )| A. | 苯酚溶液不慎沾到皮肤上,立即用酒精溶液洗涤 | |
| B. | 任何条件下,稻草不可能转变为葡萄糖或酒精 | |
| C. | 氯化汞(HgCl2)的稀溶液不可用于手术器械消毒,因为它会使人体蛋白质变性 | |
| D. | 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
分析 A.氢氧化钠具有强烈的腐蚀性;
B.稻草主要成分是纤维素,化学式为(C6H10O5)n,用适当的催化剂将纤维素与水作用生成葡萄糖,再将葡萄糖在一定条件下转化为酒精;
C.氯化汞(HgCl2)属于重金属盐能使病毒发生变性,HgCl2的稀溶液可用作手术刀的消毒剂;
D.浓硝酸能够与皮肤中的蛋白质发生颜色反应.
解答 解:A.氢氧化钠具有强烈的腐蚀性,所以不能用大量的NaOH稀溶液冲洗,可以用酒精洗去,故A错误;
B.纤维素与水在催化剂的作用下反应生成葡萄糖,葡萄糖在一定条件下反应生成乙醇和二氧化碳,故B错误;
C.氯化汞(HgCl2)的稀溶液用于手术器械消毒,是因为它会使手术器械上的病毒发生蛋白质变性,故C错误;
D.某些蛋白质能够与浓硝酸发生颜色反应,如浓HNO3使皮肤呈黄色是由于浓HNO3与蛋白质发生了颜色反应,故D正确;
故选D.
点评 本题考查化学与生活有关知识,掌握苯酚、纤维素、蛋白质的变性等知识是解答的关键,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
13.分子式为C5H12的烷烃的一氯取代物共有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: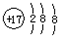 | B. | 氯化铵的电子式: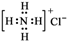 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
11.制备乙酸乙酯的装置如图所示,有关实验室制取乙酸乙酯的说法正确的是( )


| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
8.用CH3CO18OH和CH3CH2OH发生酯化反应生成酯A.据此你对该反应所得出的结论是( )
| A. | 生成物中酯A的相对分子质量为88 | |
| B. | 18O全部进入水中 | |
| C. | 18O全部进入生成的酯中 | |
| D. | 酯A与H2O水解后在CH3COOH和CH3CH2OH都有18O存在 |
15.下列物质既能与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 碳酸氢铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
12.氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
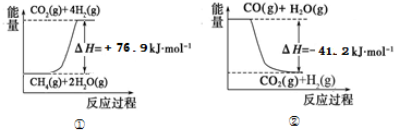
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应.
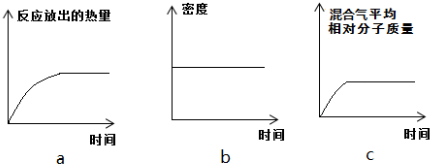
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
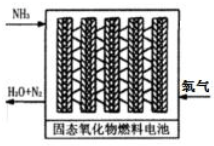
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示

反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).

(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:

①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).

 .
. +2nNaOH→n
+2nNaOH→n +(n+1)H2O.
+(n+1)H2O.