题目内容
7.有下列物质:①${\;}_{6}^{12}$C;②${\;}_{19}^{39}$K;③${\;}_{20}^{40}$Ca;④${\;}_{6}^{13}$C;⑤${\;}_{7}^{14}$N;⑥${\;}_{18}^{40}$Ar.其中:(1)互为同位素的是①④.
(2)质量数相等,但不能互称同位素的是③⑥.
(3)中子数相等,但质子数不相等的是②和③,④和⑤.
分析 含有相同质子数和不同中子数的原子互称同位素,质子数+中子数=质量数,据此分析.
解答 解:①${\;}_{6}^{12}$C的质子数为6,质量数为12,中子数=12-6=6;
②${\;}_{19}^{39}$K的质子数为19,质量数为39,中子数为39-19=20;
③${\;}_{20}^{40}$Ca的质子数为20,质量数为40,中子数为40-20=20;
④${\;}_{6}^{13}$C的质子数为6,质量数为13,中子数为13-6=7;
⑤${\;}_{7}^{14}$N的质子数为7,质量数为14,中子数为14-7=7;
⑥${\;}_{18}^{40}$Ar的质子数为18,质量数为40,中子数为40-18=22.
(1)互为同位素的是①④;故答案为:①④;
(2)质量数相等,但不能互称同位素的是③⑥;故答案为:③⑥;
(3)中子数相等,但质子数不相等的是②和③,④和⑤;故答案为:②和③,④和⑤.
点评 本题主要考查了同位素的概念及原子的构成,解答时注意从其概念的要点来分析,难度不大.

练习册系列答案
相关题目
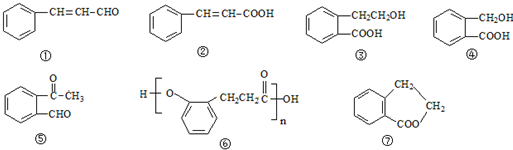
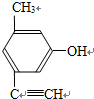
17.Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:
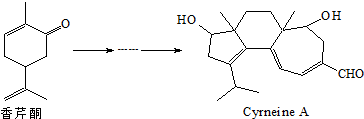
下列说法正确的是( )

下列说法正确的是( )
| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
15.下列物质既能与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 碳酸氢铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
2.化学物质的泄漏给居民生活和环境造成严重污染.下列有关说法正确的是( )
| A. | 液氨是纯净物,而氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
12.氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
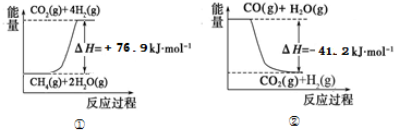
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应.
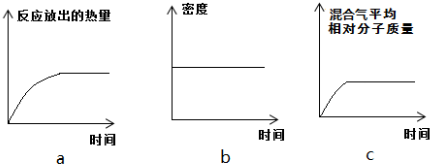
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
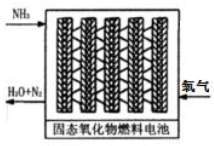
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示

反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
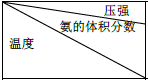 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).

(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:

①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
19.下列说法错误的是( )
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
16.根据表中维生素C的有关信息,回答下列问题
(1)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是苹果、西红柿;
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
17.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1 mol的氢氧根离子所含电子数均为9 NA | |
| B. | 1.00 mol NaCl中含有NA个NaCl分子 | |
| C. | 常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
 .
.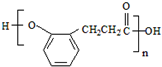 +2nNaOH→n
+2nNaOH→n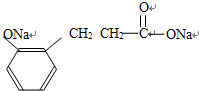 +(n+1)H2O.
+(n+1)H2O.