题目内容
17.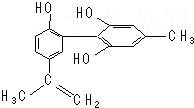 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
分析 由结构简式可知,分子中含酚-OH、碳碳双键,结合酚、烯烃的性质分析,且苯环、双键为平面结构,而分子中甲基为四面体结构,以此来解答.
解答 解:A.该有机物含有酚羟基,遇FeCl3溶液呈紫色,但含2个苯环、3个酚-OH,与苯酚结构不相似,不是苯酚同系物,故A错误;
B.酚羟基也可以还原高锰酸钾,使酸性高锰酸钾溶液褪色,则滴入KMnO4(H+)溶液,观察紫色褪去,不能证明结构中存在碳碳双键,故B错误;
C.苯环、双键为平面结构,所有碳原子可能共面,而甲基为四面体构型,所有原子不可能共面,故C错误;
D.该物质含两个苯环和一个碳碳双键,1 mol该物质最多可以与7 mol氢气加成,碳碳双键可以与Br2加成,酚羟基的邻位和对位可以与Br2取代,最多消耗4 mol Br2,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃性质及原子共面的考查,题目难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
7.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
(1)在这10种元素中,化学性质最不活泼的是⑩(写序号),失电子能力最强的原子是K(用元素符号表示).
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是KOH(填化学式),最高价氧化物的水化物酸性最强的是HClO4(填化学式).
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是HF(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):Na+<F-<Cl-
(5)写出③和⑨形成的化合物的电子式: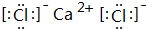 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
(2)在这10种元素中,最高价氧化物的水化物碱性最强的是KOH(填化学式),最高价氧化物的水化物酸性最强的是HClO4(填化学式).
(3)H分别与④、⑤、⑦、⑧、⑨形成的化合物中,最稳定的是HF(填化学式);
(4)①、⑧、⑨三种元素单核离子半径由小到大的顺序是(用相应的离子符号表示):Na+<F-<Cl-
(5)写出③和⑨形成的化合物的电子式:
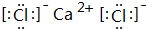 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).
8.用CH3CO18OH和CH3CH2OH发生酯化反应生成酯A.据此你对该反应所得出的结论是( )
| A. | 生成物中酯A的相对分子质量为88 | |
| B. | 18O全部进入水中 | |
| C. | 18O全部进入生成的酯中 | |
| D. | 酯A与H2O水解后在CH3COOH和CH3CH2OH都有18O存在 |
5.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核远的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
12.氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示
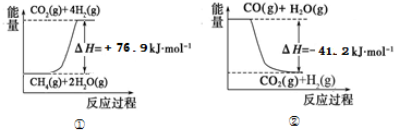
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气生成氨气的反应是正反应气体体积减小的放热反应.
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).
(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:
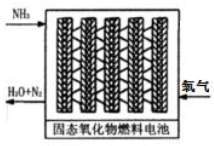
①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图所示

反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1KJ/mol.????????
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:
[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
⑤下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
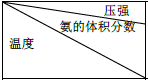 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)=0.1mol,
n(H2)=0.3mol.下列图象能正确表示该过程中相关量的变化的是ab.(选填字母).

(3)直接供氨式固体氧化物燃料电池能量转化效率达到85%,结构示意图如图:

①负极的电极反应式是2NH3-6e-+3O2-=N2+3H2O.
②用该电池电解300moL的饱和食盐水.一段时间后,溶液pH为13(忽略溶液体积的变化),则消耗NH3的体积是0.224L.(标准状况).
2.下列实验事实,不能证明苯分子中的碳碳键不是单、双键交替,而是一种介于碳碳单键与碳碳双键之间的特殊的共价键的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的邻二氯取代产物只有一种 | ||
| C. | 苯不使溴的四氯化碳溶液褪色 | D. | 苯的对二氯取代产物只有一种 |
7.已知下列元素的原子半径:
根据以上数据,磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
 ③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3
③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3