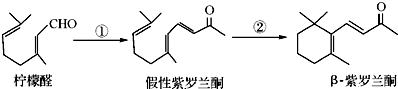
题目内容
5.氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图和阳离子交换膜电解槽装置图如下:请回答下列问题: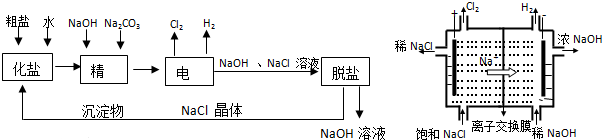
(1)粗盐含有较多杂质(含Mg2+、Ca2+),精制过程中加NaOH的作用是除去氯化镁(镁离子)
(2)电解过程中,发生反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、过滤(填写操作名称)除去NaCl,该工业流程中可循环利用的物质是NaCl
(4)已知某阳离子交换膜电解槽每小时加入10%的氢氧化钠溶液10Kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解一个小时后流出的氢氧化钠溶液的质量分数为35.7%.
(5)通过电解饱和食盐获得的氢气和氯气可用于生产高纯硅,流程如下:
石英沙$→_{高温}^{焦炭}$粗硅$→_{加热}^{氯气}$四氯化硅$→_{高温}^{氢气}$纯硅
①石英沙的主要成分是SiO2(填化学式).在制备过程时,焦炭的作用是还原剂.
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯.其提纯方法为蒸馏
③由四氯化硅得到高纯硅的化学方程式是SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
分析 (1)加入氢氧化钠主要是除去镁离子;
(2)电解氯化钠溶液生成氢氧化钠、氢气和氧气,据此书写方程式;
(3)根据氯化钠的溶解度随温度变化不大的特征进行分析;根据循环图寻找可以循环使用的物质;
(4)根据氢气的体积计算生成的氢氧化钠的质量、溶液减少的氢气的质量、溶液增加的质量(钠的质量),再根据质量分数公式计算即可;
(5)①石英砂的主要成分是二氧化硅,制备粗硅发生SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,C元素的化合价升高;
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,利用沸点差异分离;
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,以此书写化学反应.
解答 解:(1)加入氢氧化钠主要是与镁离子反应生成氢氧化镁沉淀从而除去镁离子,所以精制过程中加NaOH的作用是除去氯化镁(镁离子),故答案为:除去氯化镁(镁离子);
(2)电解氯化钠溶液的生成物是氢氧化钠、氯气和氢气,即:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂结晶的方法,除去氢氧化钠中的氯化钠;根据循环图,可以循环使用的物质是氯化钠,
故答案为:蒸发浓缩;过滤;NaCl;
(4)氢气的物质的量=$\frac{896L}{22.4L/mol}$=40mol;电解水时,生成氢气与氢氧化钠的物质的量之比为1:2,所以生成氢氧化钠的质量=2×40mol×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×40mol×23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,电解后流出的氢氧化钠溶液的质量分数=$\frac{4200g}{11760g}$=35.7%,
故答案为:35.7%;
(5)①石英砂的主要成分是二氧化硅,制备粗硅发生SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,C元素的化合价升高,则焦炭作还原剂,故答案为:SiO2;还原剂;
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,因沸点不同,则分离提纯法选蒸馏法,故答案为:蒸馏;
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,该反应为SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,故答案为:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
点评 本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力,题目难度不大.

 53天天练系列答案
53天天练系列答案| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
| A. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常温下0.1mol/L 氯化铵溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 电解精炼铜时阳极铜溶解:Cu-2e-═Cu2+ |
| A. | KAl(SO4)2溶液:c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| B. | 用酚酞作指示剂,向氨水中滴入标准盐酸至滴定终点:c(NH4+)<c(Cl-) | |
| C. | NH4Cl与Ba(NO3)2的混合溶液:c(Cl-)+2c(NO3-)=c(NH4+)+c(NH3•H2O)+c(Ba2+) | |
| D. | 饱和氯水中:c(H+)=2c(ClO-)+c(HClO)+c(OH-) |
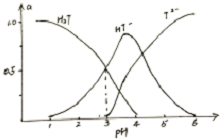 酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )
酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )| A. | 常温下,H2T?H++HT- Ka=10-3 | |
| B. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中c(H2T)<c(T2-) | |
| D. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 |
| A. | SO2 | B. | NaHSO3 | C. | CH3COONa | D. | FeCl2 |
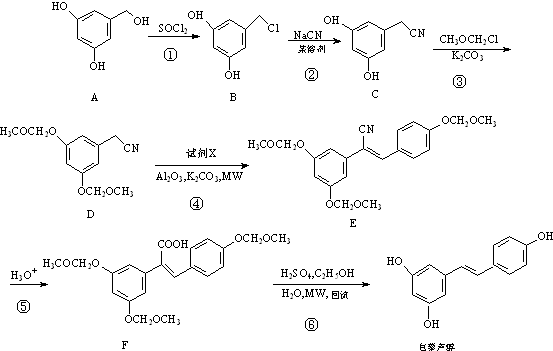
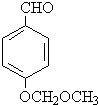 .
.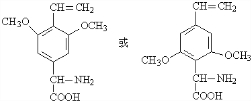 (任写一种).
(任写一种). .
.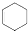 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基