题目内容
10.下列解释事实的方程式不正确的是( )| A. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常温下0.1mol/L 氯化铵溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 电解精炼铜时阳极铜溶解:Cu-2e-═Cu2+ |
分析 A.氨水为弱碱,氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵;
B.氢氧化镁为难溶物,离子方程式中不能拆开,应该保留化学式;
C.铵根离子在溶液中部分水解,溶液显示碱性;
D.电解精炼铜过程中,阳极铜失去电子生成铜离子.
解答 解:A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀氢氧化铝,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁,Mg(OH)2易转化为Fe(OH)3,反应的离子方程式为:2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3,故B错误;
C.常温下0.1mol/L 氯化铵溶液pH=5,原因是铵根离子在溶液中部分水解,水解的离子方程式为:NH4++H2O?NH3•H2O+H+,故C正确;
D.电解精炼铜时阳极铜失去电子生成铜离子,阳极的电极反应式为:Cu-2e-═Cu2+,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
20.已知A、B、C、D、E是短周期中原子序数依次增大的5中主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
1.化学与生产、生活、环境密切相关.下列说法中,不正确的是( )
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| C. | 氢氧化铝可用于制作治疗胃酸过多的药物 | |
| D. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 |
15.下列有关Ca(ClO)2溶液的叙述正确的是( )
| A. | 该溶液中,K+、Cl-、HCOOH、I-可以大量共存 | |
| B. | 与Na2SO3反应的离子方程式:ClO-+SO32-═SO42-+Cl- | |
| C. | 不可使用pH试纸测定该溶液的pH | |
| D. | 1 L 0.1 mol/L该溶液和足量的CO2充分反应,产生10 g沉淀 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | pH=12的溶液K+、Na+、CH3COO-、Br- | |
| C. | 与铝反应产生大量氢气的溶液:K+、NH4+、HCO3-、Cl- | |
| D. | 酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
19.对于结构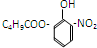 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )
 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
20.下列有关化学用语表示正确的是( )
| A. | 碳化钙(CaC2)的电子式:Ca2+[:C::C:]2- | |
| B. | ${\;}_{8}^{18}$O2-离子的结构示意图: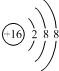 | |
| C. | 2-甲基-2-丙醇的结构简式: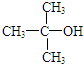 | |
| D. | Na2S水解的离子方程式:S2-+2H2O?2H2S+2OH- |