题目内容
5.下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是( )| A. | SiO2和CaO的熔化 | B. | 氧化钠和铁的熔化 | ||
| C. | 碘和干冰的气化 | D. | 晶体硅和晶体硫的熔化 |
分析 汽化或熔化时,一般分子晶体克服分子间作用力,原子晶体克服共价键;离子晶体克服离子键;金属晶体克服金属键,先判断晶体类型,只要晶体类型相同,其微粒间的作用力就相同,所以只要晶体类型相同即可,以此来解答.
解答 解:A.SiO2是原子晶体,CaO是离子晶体,熔化时克服的作用力不同,故A错误;
B.氯化钠是离子晶体,铁是金属晶体,熔化时克服的作用力不同,故B错误;
C.碘和干冰都属分子晶体,气化时都克服分子间作用力,故C正确;
D.晶体硅属于原子晶体,晶体硫是分子晶体,熔化时克服的作用力不同,故D错误.
故选C.
点评 本题以微粒间作用力为载体考查晶体类型,侧重考查学生对这几种晶体类型的判断能力,题目难度不大.

练习册系列答案
相关题目
15.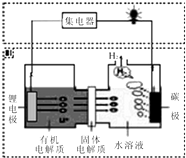 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )| A. | 碳极发生的反应是:2H2O+2e-=H2↑+2OH - | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 标况下产生22.4L的氢气时,正极消耗锂的质量为14g | |
| D. | 该装置不仅可提供电能,还可得到清洁的氢气 |
16.下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 | |
| C. | 将该溶液蒸干,得到的固体中混有氢氧化铁 | |
| D. | 100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
13.如表为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
| Q | R | ||
| T | W | ||
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为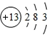 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | W可形成多种含氧酸 |
20.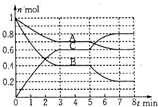 在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
 在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )| A. | V正(A)=2V逆(B) | B. | 容器内混合气体的密度保持不变 | ||
| C. | 容器内的总压强保持恒定 | D. | A、B的转化率之比为1:2 |
10.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的最高价氧化物对应水化物是Al(OH)3.
①在元素周期表中的位置是(周期、族)第二周期ⅥA族.
(2)碱性最强的化合物的电子式是: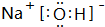 ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的最高价氧化物对应水化物是Al(OH)3.
①在元素周期表中的位置是(周期、族)第二周期ⅥA族.
(2)碱性最强的化合物的电子式是:
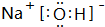 ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
15.不用其他化学试剂(可以加热或利用水)就能区别开的一组物质是( )
| A. | 苯、甲苯、四氯化碳 | B. | 酒精、硝基苯、四氯化碳 | ||
| C. | 溴苯、苯、四氯化碳 | D. | 酒精、甲苯、四氯化碳 |


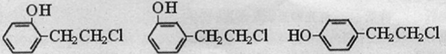 或
或 .
. ,请写出其涉及的反应(著注明反应的条件)
,请写出其涉及的反应(著注明反应的条件) 、
、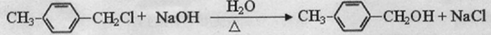 .
.