题目内容
17.液氨是一种良好的储氢物质.
已知:①2NH3(g)?N2 (g)+3H2(g)△H=+92.4kJ•mol-1
②液氨中2NH3(l)?NH2-+NH4+
(1)氨气自发分解的反应条件是高温(填“低温”或“高温”).
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.反应的活化能最大的是Fe(填催化剂的化学式).
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示.
①a点所代表的状态是(填“是”或“不是”)平衡状态.
②c点氨气的转化率高于b点,原因是b、c点均未达到平衡,c点温度较高,反应速率较快,故氨气的转化率较高.
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线.
④假设Ru催化下,温度为750℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的平衡常数K=0.12 c02.
(4)用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是2NH3+2e-=H2↑+2NH2-.
分析 (1)氨气分解为熵增的反应,根据△G=△H-T△S<0,反应可以自发进行;
(2)反应的活化能越高,则反应中活化分子数越少,反应速率越慢;
(3)①850°以后氨气的转化率不变,说明a点处于平衡状态;
②b、c点均未达到平衡,c点温度较高,反应速率较快;
③Ni催化分解氨气,平衡时α(NH3)不变,Ni的催化效率高于Fe、小于Rh,一定温度下,氨气的转化率应大于Fe、小于Rh;
④根据氨气的转化率,计算平衡时氨气浓度变化量,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式K=$\frac{c({N}_{2})×{c}^{3}({H}_{3})}{{c}^{2}(N{H}_{3})}$计算;
(4)液氨中氨气发生微弱电离得到NH2-与NH4+,阴极发生还原反应,类比水的电解,可知阴极上NH3获得电子生成H2与NH2-.
解答 解:(1)△G=△H-T△S<0,反应可以自发进行,氨气分解为熵增的反应,且△H为增大反应,故反应在高温下可以自发进行,
故答案为:高温;
(2)反应的活化能越高,则反应中活化分子数越少,反应速率越慢,则氨气的分解速率最慢的反应中,氨气分解反应的活化能最大,即当Fe作催化剂时活化能最大,
故答案为:Fe;
(3)①850°以后氨气的转化率不变,说明a点处于平衡状态,故答案为:是;
②b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高,
故答案为:b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高;
③Ni催化分解氨气,平衡时α(NH3)不变,Ni的催化效率高于Fe、小于Rh,一定温度下,氨气的转化率应大于Fe、小于Rh,故Ni催化分解氨气过程的总趋势曲线为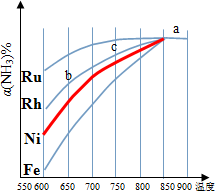 ,
,
故答案为: ;
;
④氨气的初始浓度为c0,平衡转化率为40%,则平衡时氨气浓度变化量为0.4c0,则:
2NH3(g)?N2 (g)+3H2(g)
开始(mol/L):c0 0 0
转化(mol/L):0.4c0 0.2c0 0.6c0
平衡(mol/L):0.6c0 0.2c00.6c0
故平衡常数表达式K=$\frac{c({N}_{2})×{c}^{3}({H}_{3})}{{c}^{2}(N{H}_{3})}$=$\frac{0.2{c}_{0}×(0.6{c}_{0})^{3}}{(0.6{c}_{0})^{2}}$=0.12 c02,
故答案为:0.12 c02;
(4)液氨中氨气发生微弱电离得到NH2-与NH4+,阴极发生还原反应,类比水的电解,可知阴极上NH3获得电子生成H2与NH2-,阴极的电极反应式是:2NH3+2e-=H2↑+2NH2-,
故答案为:2NH3+2e-=H2↑+2NH2-.
点评 本题考查反应自发性判断、化学反应速率及化学平衡影响因素、平衡常数计算、电解原理,侧重考查学生的分析能力、对知识的应用能力,难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | H+(aq)+$\frac{1}{2}$SO42-(aq)+$\frac{1}{2}$Ba2+(aq)+OH-(aq)═$\frac{1}{2}$BaSO4(s)+H2O(1);△H=-57.3 kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2 (g)═8CO2 (g)+9H2O(g);△H=-5518 kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)═16CO2 (g)+18H2O(1);△H=-5518 kJ/mol |
| A. | SiO2和CaO的熔化 | B. | 氧化钠和铁的熔化 | ||
| C. | 碘和干冰的气化 | D. | 晶体硅和晶体硫的熔化 |
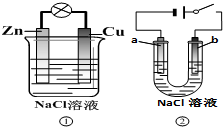
| A. | 装置①中的铜棒上冒气泡 | |
| B. | 若b是惰性电极,则装置②中的a、b 冒气泡 | |
| C. | 装置①换上硫酸铜溶液,将实现锌片上镀铜 | |
| D. | 装置②换上硫酸铜溶液,将实现“b极”镀铜 |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
| A. | H+、Cu2+、Fe3+、SO42- | B. | Na+、Ba2+、Al3+、Cl- | ||
| C. | K+、Ag+、NH4+、NO3- | D. | Na+、K+、Br-、OH- |

 .
. .
.