题目内容
16.下列有关Fe2(SO4)3溶液的叙述正确的是( )| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 | |
| C. | 将该溶液蒸干,得到的固体中混有氢氧化铁 | |
| D. | 100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
分析 Fe2(SO4)3溶液中铁离子部分水解,导致溶液显示酸性,其中的铁离子具有氧化性,能和还原性的物质反应,根据溶液的环境以及铁离子的性质来回答.
解答 解:A、铁离子具有氧化性,该溶液中I-不可以大量共存,故A错误;
B、该溶液中溶解一定量铜粉,铜和铁离子会发生反应生成亚铁离子、铜离子,向所得溶液中再加入铁粉,若溶液中有Cu2+,则铁少量,先是和铁离子之间反应,有可能和部分铜离子之间反应,可能会析出金属铜,故B错误;
C、硫酸铁水解得到的非挥发性得酸硫酸,将该溶液蒸干,得到的固体是硫酸铁,故C错误;
D、100mL 0.1 mol/L该溶液中含有溶质硫酸铁0.01mol,0.01mol硫酸铁中含有0.02mol铁离子,与足量锌反应可以生成0.02mol铁,生成铁的质量为1.12g,故D正确.
故选D.
点评 本题考查了离子共存的判断、离子的性质以及盐的水解原理知识,题目难度中等,注意掌握离子反应发生条件.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
7.25℃,101k Pa时,强酸与强碱的稀溶液发生反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
| A. | H+(aq)+$\frac{1}{2}$SO42-(aq)+$\frac{1}{2}$Ba2+(aq)+OH-(aq)═$\frac{1}{2}$BaSO4(s)+H2O(1);△H=-57.3 kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2 (g)═8CO2 (g)+9H2O(g);△H=-5518 kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)═16CO2 (g)+18H2O(1);△H=-5518 kJ/mol |
4.下列对分子的性质的解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸(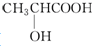 )有一对手性异构体,因为其分子中含有一个手性碳原子 )有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多 |
11.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 石英可导电,用于生产光导纤维 | |
| B. | 常见的氮肥都属于铵盐类无机物 | |
| C. | 粗盐经过溶解、过滤、蒸发结晶,即可得到纯净物氯化钠 | |
| D. | 生活中食用的食醋、植物油、动物蛋白等物质都是混合物 |
5.下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是( )
| A. | SiO2和CaO的熔化 | B. | 氧化钠和铁的熔化 | ||
| C. | 碘和干冰的气化 | D. | 晶体硅和晶体硫的熔化 |
6.硫及其化合物用途广泛,许多金属硫化物难溶于水
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
根据上表判断NaHSO3溶液显酸性,理由是HSO3-?H++SO32-,显酸性是因其电离大于其水解
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
 ,
,
 、F
、F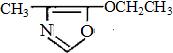 .
.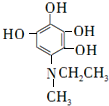 等.
等. .
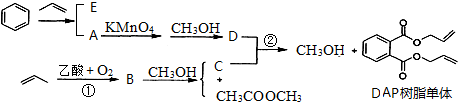
.

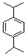 .
. .
.