题目内容
14.反应“M”是有机合成中常见的增长C链的方法:
(1)有关化合物Ⅰ的说法正确的是C
A.不能与酸性高锰酸钾反应
B.1mol化合物Ⅰ最多能与4molH2加成
C.可与NaOH溶液反应
D.属于芳香烃
(2)化合物Ⅱ的分子式为C10H11O2Cl,1mol化合物Ⅱ与NaOH溶液反应最多消耗2molNaOH.
(3)化合物Ⅲ可能与乙酸制备化合物Ⅱ,化合物Ⅳ为Ⅲ的同分异构体,Ⅳ遇FeCl3溶液显紫色,且能与NaOH醇溶液发生消去反应,请写出一种Ⅳ的结构简式
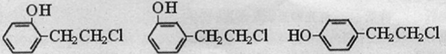 或
或 .
.(4)利用类似反应“M”的方法,以甲苯为原料,制备
 ,请写出其涉及的反应(著注明反应的条件)
,请写出其涉及的反应(著注明反应的条件) 、
、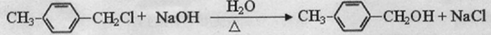 .
.
分析 (1)根据化合物I的结构简式判断其含有的官能团,根据官能团类型判断其具有的化学性质;
(2)根据化合物Ⅱ的结构简式判断其分子式;根据化合物Ⅱ的结构判断1mol该有机物最多消耗氢氧化钠的物质的量;
(3)化合物Ⅲ可与乙酸制备化合物Ⅱ,则化合物Ⅲ的结构简式为: ,结合同分异构体的书写原则及题中限制条件写出满足条件的有机物的结构简式;
,结合同分异构体的书写原则及题中限制条件写出满足条件的有机物的结构简式;
(4)根据反应原料,结合题中信息反应原理写出发生反应的化学方程式.
解答 解:(1)A.化合物Ⅰ分子中,连接苯环的侧链C上含有H原子,能够与酸性高锰酸钾反应,故A错误;
B.该有机物分子中含有1个苯环,则1mol化合物I最多能与3moH2加成,故B错误;
C.该有机物分子中含有酯基,能够与NaOH溶液发生水解反应,故C正确;
D.该有机物分子中除了含有C、H元素外还含有O元素,所以不属于芳香烃,故D错误;
故答案为:C;
(2)根据化合物Ⅱ的结构简式可知,其分子式为:C10H11O2Cl;1mol化合物Ⅱ中含有1mol酯基、1molCl原子,所以1mol化合物Ⅱ最多能够消耗2mol氢氧化钠,
故答案为:C10H11O2Cl;2;
(3)化合物Ⅲ可与乙酸制备化合物Ⅱ,则化合物Ⅲ的结构简式为: ;化合物Ⅳ为Ⅲ的同分异构体,Ⅳ遇 FeCl3溶液显紫色,且能与NaOH醇溶液发生消去反应,说明化合物Ⅳ中含有酚羟基,且能够发生消去反应,满足条件的有机物的结构简式有:
;化合物Ⅳ为Ⅲ的同分异构体,Ⅳ遇 FeCl3溶液显紫色,且能与NaOH醇溶液发生消去反应,说明化合物Ⅳ中含有酚羟基,且能够发生消去反应,满足条件的有机物的结构简式有: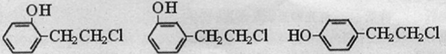 、
、 ,
,
故答案为: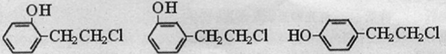 或
或 (任选一种);
(任选一种);
(4)用甲苯制备 ,根据信息反应原理可知,先发生反应:
,根据信息反应原理可知,先发生反应: ,然后发生反应
,然后发生反应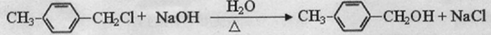 生成目标产物,
生成目标产物,
故答案为: 、
、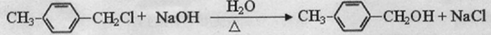 .
.
点评 本题考查了有机合成,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意合理分析、利用题中信息反应原理,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸(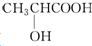 )有一对手性异构体,因为其分子中含有一个手性碳原子 )有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多 |
| A. | SiO2和CaO的熔化 | B. | 氧化钠和铁的熔化 | ||
| C. | 碘和干冰的气化 | D. | 晶体硅和晶体硫的熔化 |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 激素类药物乙烯雌酚的结构简式为: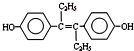 ,它的分子式是:C18H20O2 ,它的分子式是:C18H20O2 | |
| B. | 等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 聚乳酸(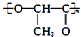 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实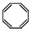 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. |
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 该电池的总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| D. | 电池工作时,正极周围溶液的pH将不断变小 |