题目内容
14.位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是( )| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
分析 位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,则Y在X的下一周期,原子序数:Y>X;若X为C,则Y为Mg;若X为N,则Y为Si;若X为O,则Y为S等有多种组合,据此分析.
解答 解:位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,则Y在X的下一周期,原子序数:Y>X;若X为C,则Y为Mg;若X为N,则Y为Si;若X为O,则Y为S等有多种组合;
A.Y在X的下一周期,电子层数越多,原子半径越大,所以X元素原子的半径一定小于Y元素原子的半径,故A正确;
B.若X为O,则Y为S,则二氧化硫与水反应生成亚硫酸,故B错误;
C.若X为O,O与H形成的H2O2中含有O-O非极性键,故C错误;
D.若X为O,则Y为S,则Y元素与X元素原子的最外层电子数相同,故D错误.
故选A.
点评 本题考查了原子结构与元素的性质,题目难度不大,注意元素的不确定性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列叙述错误的是( )
| A. | 氧化铁常用作红色油漆和涂料 | |
| B. | 司母戊鼎是青铜制品 | |
| C. | 光导纤维的主要成分是硅酸盐 | |
| D. | 常温下可用铁制或铝制容器盛装浓硫酸 |
19.常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是( )
| A. | c(CH3COO-)+c(OH-)=0.01 mol•L-1 | |
| B. | 与等体积pH=12的氨水混合后所得溶液显酸性 | |
| C. | 加入少量醋酸钠固体后所得溶液中c(CH3COO-)减小 | |
| D. | 与等体积0.01 mol•L-1NaNO3溶液混合后有:c(NO3-)=c(CH3COO-)+c(CH3COOH) |
6.室温下,下列溶液中粒子浓度大小关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 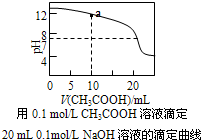 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
3.某微粒用${\;}_{Z}^{A}{R}^{n+}$表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
4.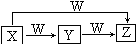 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )| A. | 若X为HNO3,则W可能为Fe | |
| B. | 若W为O2,X可能是S | |
| C. | 若W为O2,则Z可能为NO | |
| D. | X→Z的离子反应可能为Al3++4OH-=AlO2-+2H2O |
 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.