题目内容
9.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)═N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.(1)若已知N2(g)+O2(g)═2NO(g)△H=-a kJ/mol,则还需要知道热化学方程式:C(s)+O2(g)=CO2(g)△H=-bkJ/mol(反应热的绝对值用b表示),即可求出用活性炭还原法处理NO反应的反应热.
(2)该化学平衡常数表达式K=$\frac{c({N}_{2})c({O}_{2})}{{c}^{2}(NO)}$,已知升高温度时,K增大,则正反应为吸热(填“吸热”或“放热”)反应.
(3)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为0.05mol/(L•min).
(4)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是移走生成物N2和(或)CO2.
(5)下列各项能判断该反应t1时刻后达到平衡的图1示是abc(填序号字母).

(6)图2是以甲醇为燃料的新型固体氧化物燃料电池工作原理示意图.回答下列问题:
①B极的电极反应式为CH3OH+3O2--6e-=CO2+2H2O.
②若用该燃料电池做电源,给某铁质水管上镀锌,当A极消耗标况下1.12L O2,水管增重的质量是6.5克.
分析 (1)依据盖斯定律和热化学方程式计算求出用活性炭还原法处理NO反应的反应热.
(2)平衡常数K=$\frac{生成物平衡你的幂次方乘积}{反应物平衡浓度幂次方乘积}$,升温平衡常数增大说明正反应为吸热反应;
(3)气体密度增大了1.2g/L,可以计算出固体C的质量减小了2.4g,可以计算氮气的物质的量的变化量,进而计算反应速率;
(4)在温度不变的情况下,要提高NO的平衡转化率,只要是化学平衡正向移动即可;
(5)反应前后气体质量增加,气体体积不变,结合平衡的标志是正逆反应速率相同,各组成含量保持不变,变量不变分析选项;
(6)①B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
②当A极消耗标况下1.12L O2,A电极为正极,水管做阴极,结合电子守恒计算阴极析出锌的质量;
解答 解:(1)依据盖斯定律利用热化学方程式计算,①C(s)+2NO(g)═N2(g)+CO2(g),②N2(g)+O2(g)═2NO(g)△H=-a kJ/mol,还
需要的热化学方程式为①+②得到:C(s)+O2 (g)=CO2(g)△H=-b kJ/mol;
故答案为:C(s)+O2 (g)=CO2(g)△H=-b kJ/mol;
(2)化学平衡常数K=$\frac{生成物平衡你的幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{c({N}_{2})c({O}_{2})}{{c}^{2}(NO)}$,温度升高,K增大,则该反应是吸热反应,故答案为:$\frac{c({N}_{2})c({O}_{2})}{{c}^{2}(NO)}$;吸热;
(3)根据题意,气体密度增大了1.2g/L,计算出固体C的质量减小了2.4g,则生成氮气的物质的量是$\frac{2.4g}{12g/mol}$=0.2mol,所以氮气表示的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故答案为:0.05;
(4)在温度不变的情况下,减小产物的浓度可以让平衡争相与移动,从而提高NO的平衡转化率,故答案为:移走生成物N2和(或)CO2;
(5)C(s)+2NO(g)═N2(g)+CO2(g),反应前后气体体积不变,气体质量增加,
a、图象表示随时间变化气体质量不变,说明反应达到平衡状态,故a符合;
b、图象分析可知气体质量增大,气体物质的量不变,相对分子质量不变说明反应达到平衡状态,故b符合;
c、密度ρ=$\frac{m}{V}$,反应前后气体质量增大,气体体积不变,当密度不变反应达到平衡状态,故c符合;
d、反应前后压强不变,压强不变不能说明反应达到平衡状态,故c不符合;
故答案为:a b c;
(6)①B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:CH3OH+3O2--6e-=CO2+2H2O;
②当A极消耗标况下1.12L O2,物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,A电极为正极,电极反应,4OH--4e-=2H2O+O2↑,水管做阴极,Zn-2e-=Zn2+,结合电子守恒得到
O2↑~2Zn2+~4e-
0.05mol 0.1mol
水管增重的质量为 65g/mol×0.1mol=6.5g
故答案为:6.5;
点评 本题综合考查学生化学反应速率的计算、化学平衡的移动、平衡状态的判断以及溶电解池原理的分析等知识,主要是图象分析判断平衡的标志,注意知识的归纳和整理是关键,难度不大.

| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
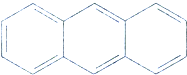 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
| A. | NH4+、Cl-、Na+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ca2+、H+、S2-、ClO- | D. | H+、Cl-、Fe2+、NO3- |
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
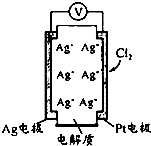 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )| A. | 电子经外电路流向Pt电极 | |
| B. | 正极反应:Cl2+2e-+2Ag+=2AgCl | |
| C. | 电池工作时,电解质中Ag+数目减少 | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿 | |
| B. | 除去CO2气体中混有的少量HCl:导管、洗气瓶 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |