题目内容
6.室温下,下列溶液中粒子浓度大小关系正确的是( )| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 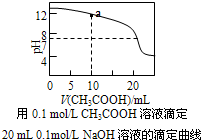 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
分析 A.反应后溶质为碳酸钠,溶液中氢氧根离子来自碳酸根离子的水解和水的电离,则c(OH-)>c(HCO3-);
B.三种盐都是强碱弱酸盐,弱酸根离子对应的酸的酸性越强,酸根离子的水解程度越小,pH相同时其浓度越大;
C.根据硫化钠溶液中的质子守恒判断;
D.a点时醋酸体积为10mL,反应后溶质为等浓度的氢氧化钠和醋酸钠,结合电荷守恒和物料守恒分析.
解答 解:A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成碳酸钠,碳酸根离子部分水解,溶液显示碱性,由于溶液中氢氧根离子来自碳酸根离子的水解和水的电离,则c(OH-)>c(HCO3-),溶液中正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.①CH3COONa②NaHCO3③NaAlO2三份溶液中,偏铝酸根离子对应的酸的酸性最弱、醋酸的酸性最强,则水解程度大小为:③>②>①,所以pH相同时,三种溶液的浓度大小为:①>②>③,钠离子不水解,则钠离子浓度大小为:①>②>③,故B错误;
C.0.1mol•L-1的硫化钠溶液中,根据质子守恒可知:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.结合图象可知,a点时有一半的氢氧化钠参与反应,反应后溶质为等浓度的NaOH和醋酸钠,根据电荷守恒可知:①c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:②c(Na+)=2c(CH3COO-)+2c(CH3COOH),将②带入①可得:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
故选D.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,注意明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用.

| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
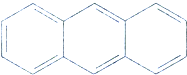 ,它的二溴代物的同分异构体的数目为( )
,它的二溴代物的同分异构体的数目为( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
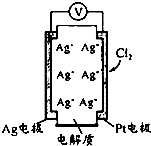 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )| A. | 电子经外电路流向Pt电极 | |
| B. | 正极反应:Cl2+2e-+2Ag+=2AgCl | |
| C. | 电池工作时,电解质中Ag+数目减少 | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
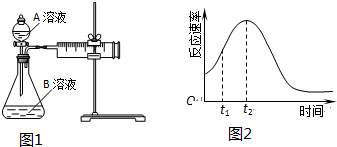
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
| A. | 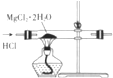 制取无水MgCl2 | B. |  除去CO2气体中的HCl气体 | ||
| C. | 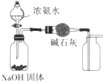 制取并收集干燥纯净的NH3 | D. | 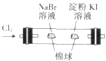 证明氧化性:Cl2>Br2>I2 |
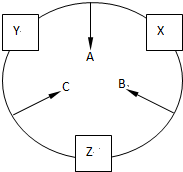 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
 NH4++OH-.
NH4++OH-.