题目内容
19.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.1mol/L c(CO32-)=0.1mol/L |
分析 第一份溶液中加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
第二份溶液中产生的0.03mol为氨气,溶液中一定含有NH4+,并且物质的量为0.03mol;
第三份中2.33g为硫酸钡,4.30g为硫酸钡和碳酸钡,根据n=$\frac{m}{M}$计算出沉淀的物质的量及碳酸根离子的浓度;
再根据电荷守恒,得出一定存在钾离子,并计算出钾离子的浓度范围,据此进行解答.
解答 解:第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-;
第二份加足量NaOH溶液加热后,收集到气体0.03mol,能和NaOH溶液加热产生气体的只能是NH4+,根据反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,产生NH3为0.03mol,可得NH4+也为0.03mol;
第三份加足量BaCl2溶液后,得干燥沉淀4.30g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解,因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+;
由条件可知BaSO4为2.33g,物质的量为$\frac{2.33g}{233g/mol}$=0.01mol,BaCO3为4.30g-2.33g═1.97g,物质的量为$\frac{1.97g}{197g/mol}$=0.01mol,
则CO32-物质的量为0.02mol,CO32-物质的量浓度为$\frac{0.02mol}{0.1L}$=0.2mol/L,
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物质的量分别为0.01mol、0.01mol、0.03mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.03mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01mol,则钾离子的浓度c(K+)≥$\frac{0.01mol}{0.1L}$=0.1mol/L,
所以溶液中该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,故A正确、BC错误;
溶液中c(K+)≥0.1mol/L c(CO32-)=0.1mol/L,故D正确;
故选AD.
点评 本题考查无机推断,题目难度中等,明确常见离子的性质为解答关键,试题采用定性实验和定量计算分析相结合的模式,增大了解题难度,明确常见离子的性质为解答关键,根据电荷守恒推断钾离子的存在情况为解答关键,试题培养了学生的分析能力及逻辑推理能力.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 二氧化硫与足量氢氧化钠溶液反应 SO2+2OHˉ=SO32-+H2O | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-═2A1O${\;}_{2}^{-}$+H2↑ |
| A. | 移液后未洗涤烧杯 | |
| B. | 在容量瓶中进行定容时,仰视刻度线 | |
| C. | 在容量瓶中进行定容时,俯视刻度线 | |
| D. | 定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
| A. | 用钠制取钛:TiCl4+4Na=4NaCl+Ti该反应转移4e- | |
| B. | SO2+2H2S=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为2:3 | |
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,二氧化硅是氧化剂,C是还原剂 | |
| D. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2中,每生成1molHg反应转移4mole- |
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
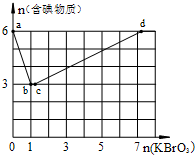 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
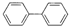 分子式:C12H10
分子式:C12H10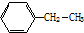 其苯环上的一氯代物有_5种
其苯环上的一氯代物有_5种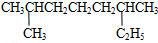 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷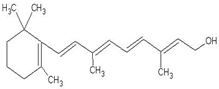 1mol该物质消耗5molH2,5molBr21molNa
1mol该物质消耗5molH2,5molBr21molNa