题目内容
14.(1)写出下列基团(或官能团)的名称或结构简式:-CH2CH3乙基、-Br溴原子、碳碳三键-C≡C-
(2)乙烯的空间构型平面结构
(3)乙炔的电子式

(4)苯的同系物的通式CnH2n-6(n≥6的整数)
(5)
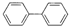 分子式:C12H10
分子式:C12H10(6)
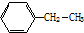 其苯环上的一氯代物有_5种
其苯环上的一氯代物有_5种(7)2,5-二甲基-4-乙基庚烷(写出结构简式)(CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3
(8)4,4,5-三甲基-2-己炔(写出结构简式)CH3C≡C-C(CH3)2CH(CH3)2
(9)
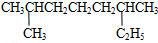 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷(10)
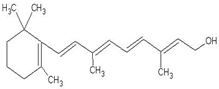 1mol该物质消耗5molH2,5molBr21molNa
1mol该物质消耗5molH2,5molBr21molNa(11)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是浓溴水;
(12)写出C5H8属于炔烃的所有同分异构体CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2.
分析 (1)熟悉常见原子团的书写方法以及常见官能团的结构简式和名称即可轻松解答;
(2)乙烯是空间平面结构的分子;
(3)根据化学键类型及原子间形成共用电子对数目解答;
(4)苯的同系物的通式CnH2n-6(n≥6的整数);
(5)根据结构简式结合碳原子的成键特点书写分子式;
(6)有机物中的等效氢原子有几种,其一氯代物就有几种;
(7)(9)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;据此回答;
(8)根据炔烃的命名原则写出4,4,5-三甲基-2-己炔的结构简式;
(10)有机物中的双键可以被氢气以及溴单质加成,其中的羟基可以和金属钠之间反应;
(11)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,有机层在上方;碘化钾与溴水发生氧化还原反应生成单质碘;硝酸银与溴水反应生成浅黄色沉淀;己烯与溴发生加成反应,溴水颜色褪去;四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,有机层在下层,可用浓溴水鉴别有机物;
(12)分子式为C5H8的炔烃有官能团位置异构、碳链异构.
解答 解:(1)-CH2CH3为乙基,-Br为卤素中的溴原子;三键-C≡C-,故答案为:乙基;溴原子;-C≡C-;
(2)乙烯是空间平面结构的分子,故答案为:平面结构;
(3)乙炔中碳原子最外层有4个电子,要达到稳定结构要形成四对共用电子对,而1个氢原子只能与1个碳原子形成形成1对公用电子对,所以碳原子和碳原子间只能形成3对公用电子对,所以乙炔的电子式为 ,故答案为:
,故答案为: ;
;
(4)苯的同系物的通式CnH2n-6(n≥6的整数),故答案为:CnH2n-6(n≥6的整数);
(5) 分子式是C12H10,故答案为:C12H10;
分子式是C12H10,故答案为:C12H10;
(6)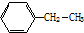 中存在5中等效氢原子,所以 其苯环上的一氯代物有5种,故答案为:5;
中存在5中等效氢原子,所以 其苯环上的一氯代物有5种,故答案为:5;
(7)2,5-二甲基-4-乙基庚烷,最长的主链含有7个C原子,甲基处于2、5号碳原子上,乙基处于4号碳原子上,其结构简式为:CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3,故答案为:(CH3)2CHCH2CH(C2H5)CH(CH3)CH2CH3.
(8)4,4,5-三甲基-2-己炔,该有机物主链为己炔,碳碳三键在2号C,在4、4、5号C原则各含有1个甲基,该有机物的结构简式为:CH3C≡C-C(CH3)2CH(CH3)2,故答案为:CH3C≡C-C(CH3)2CH(CH3)2;
(9)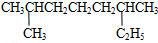 的主链碳原子数数目是8个,为辛烷,在2、6号碳原子上有甲基,名称为:2,6-二甲基辛烷,故答案为:2,6-二甲基辛烷;
的主链碳原子数数目是8个,为辛烷,在2、6号碳原子上有甲基,名称为:2,6-二甲基辛烷,故答案为:2,6-二甲基辛烷;
(10)有机物中的双键5mol可以被氢气以及溴单质加成,分别消耗氢气和溴单质是5mol,其中的羟基1mol可以和1mol金属钠之间反应,故答案为:5;5;1;
(11)苯不溶于水,密度比水小,可以萃取溴水中的溴,溶液分层,层由无色变为橙红色,下层由橙色变为无色,碘化钾与溴水发生氧化还原反应生成单质碘,溶液颜色由无色变为黄色,硝酸银与溴水反应生成浅黄色沉淀,己烯与溴发生加成反应,溶液分层,上,下两层均变为无色,四氯化碳不溶于水,但密度比水大,可以萃取溴水中的溴,溶液分层,上层由橙色变为无色,下层由无色变为橙红色,所以可以用溴水来进行鉴别,故答案为:浓溴水;
(12)分子式为C5H8的炔烃,可能的结构简式有:CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2,
故答案为:CH≡CCH2CH2CH3、CH3C≡CCH2CH3、CH≡CCH(CH3)2.
点评 本题涉及有机物的同分异构体的书写、有机物的命名、有机物的空间结构、有机物的鉴别等方面的知识,属于综合知识的考查,注意知识的归纳和梳理是关键,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1.0 L 1.0 mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| A. | NaOH固体置于大小相同的滤纸上称量 | |
| B. | 蒸馏操作时,冷凝水的方向须与气体的流向相同 | |
| C. | 配制稀硫酸时,将浓硫酸溶解后直接转移入容量瓶 | |
| D. | 分液时,先要打开分液漏斗上口活塞,再打开旋塞 |
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.1mol/L c(CO32-)=0.1mol/L |
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
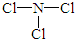 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
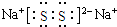 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
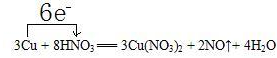 .
.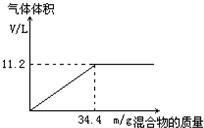 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.