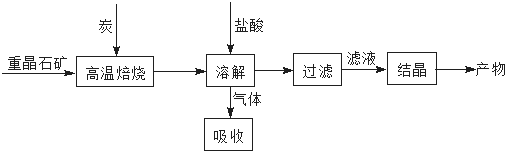
题目内容
8.下列说法正确的是( )| A. | 用钠制取钛:TiCl4+4Na=4NaCl+Ti该反应转移4e- | |
| B. | SO2+2H2S=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为2:3 | |
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,二氧化硅是氧化剂,C是还原剂 | |
| D. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2中,每生成1molHg反应转移4mole- |
分析 A.Na元素的化合价由0升高为+1价,以此计算转移电子;
B.氧化产物与还原产物均为S,结合S原子守恒计算;
C.C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价;
D.Hg、O元素的化合价降低,S元素的化合价升高,结合S元素的化合价计算转移电子.
解答 解:A.Na元素的化合价由0升高为+1价,则TiCl4+4Na=4NaCl+Ti该反应转移4e-,故A正确;
B.氧化产物与还原产物均为S,失去电子被氧化,得到电子被还原,结合S原子守恒可知氧化产物与还原产物的物质的量之比为2:1,故B错误;
C.C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,则C为氧化剂,也为还原剂,故C错误;
D.Hg、O元素的化合价降低,S元素的化合价升高,由S元素的化合价变化可知每生成1molHg反应转移6mole-,故D错误;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及转移电子计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.CO2、Fe2O3、Na2SO4溶液、Ba(OH)2溶液、盐酸五种物质,在常温下两种物质间能发生的化学反应有( )
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
19.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.03mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀4.30g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是( )
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.1mol/L c(CO32-)=0.1mol/L |
3.有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期.相关信息如下:
I.(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为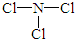 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为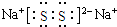 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
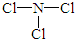 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
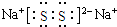 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.