题目内容
【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。
【答案】CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol -93 +226.7kJ/mol
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据△H=反应物总键能-生成物总键能计算;
(3)根据盖斯定律计算反应的焓变。
(1)16gCH3OH(l)在氧气中燃烧生成CO2和液态水,放出363.25kJ热量,则32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.5kJ热量,则△H=-726.5kJ/mol,则甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol;
(2)N2(g)+3H2(g)![]() 2NH3(g) △H=反应物总键能-生成物总键能=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1=a kJmol-1,因此a=-93;
2NH3(g) △H=反应物总键能-生成物总键能=945kJmol-1+436kJmol-1×3-391kJmol-1×6=-93kJmol-1=a kJmol-1,因此a=-93;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1;②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJmol-1;③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H2=-2599kJmol-1;2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×![]() -③×
-③×![]() 得到,所以反应焓变△H=2×(-393.5kJmol-1)+(-571.6kJmol-1)×
得到,所以反应焓变△H=2×(-393.5kJmol-1)+(-571.6kJmol-1)×![]() -(-2599kJmol-1)×
-(-2599kJmol-1)×![]() =+226.7kJmol-1。
=+226.7kJmol-1。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】(1)反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
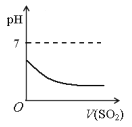
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:

①该条件下反应的平衡常数为___;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为___mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填序号)。
增大的是___(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉