题目内容
【题目】(1)反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
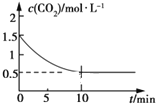
①该条件下反应的平衡常数为___;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为___mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填序号)。
增大的是___(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
【答案】![]() 吸热 2.0 0.67(或2/3) A
吸热 2.0 0.67(或2/3) A
【解析】
(1)根据盖斯定律,结合化学平衡常数表达式分析解答;
(2)①根据图像,结合Fe(s)+CO2(g)![]() FeO(s)+CO(g)计算出平衡时二氧化碳和CO的浓度,求出K;再根据K计算平衡时二氧化碳浓度;
FeO(s)+CO(g)计算出平衡时二氧化碳和CO的浓度,求出K;再根据K计算平衡时二氧化碳浓度;
②Fe(s)+CO2(g)![]() FeO(s)+CO(g)中
FeO(s)+CO(g)中![]() =K,K只随温度变化,不随浓度压强等因素变化,据此分析判断。
=K,K只随温度变化,不随浓度压强等因素变化,据此分析判断。
(1)已知①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H1,K1=
FeO(s)+CO(g) △H1,K1=![]() ,②Fe(s)+H2O(g)
,②Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H2,K2=
FeO(s)+H2(g) △H2,K2=![]() ,据盖斯定律,①-②得:CO2(g)+H2(g)
,据盖斯定律,①-②得:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=△H1-△H2,K=
CO(g)+H2O(g) △H=△H1-△H2,K=![]() =
=![]() ;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,故答案为:
;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,故答案为:![]() ;吸热;
;吸热;
(2)①根据图像,Fe(s)+CO2(g) ![]() FeO(s)+CO(g)平衡时,二氧化碳和CO的浓度分别为0.5mol/L和1mol/L,K=
FeO(s)+CO(g)平衡时,二氧化碳和CO的浓度分别为0.5mol/L和1mol/L,K=![]() =
=![]() =2.0;若CO2的起始浓度为2.0molL-1,根据方程式可知,反应的二氧化碳的浓度与生成CO浓度相等,设为xmol/L,则平衡时二氧化碳浓度为(2.0-x)mol/L,K=
=2.0;若CO2的起始浓度为2.0molL-1,根据方程式可知,反应的二氧化碳的浓度与生成CO浓度相等,设为xmol/L,则平衡时二氧化碳浓度为(2.0-x)mol/L,K=![]() =
=![]() =2.0,解得:x=
=2.0,解得:x=![]() ,平衡时二氧化碳浓度=2.0 mol/L -
,平衡时二氧化碳浓度=2.0 mol/L -![]() mol/L =
mol/L =![]() mol/L,故答案为:2.0;
mol/L,故答案为:2.0;![]() ;
;
②Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,平衡常数K=
FeO(s)+CO(g) ΔH>0,平衡常数K=![]() ,只随温度变化,不随浓度压强等因素变化。A.升高温度,平衡正向进行,平衡常数增大,故A正确;B.增大压强,平衡不移动,平衡常数不变,故B错误;C.充入一定量CO2,平衡正向进行,但平衡常数K=
,只随温度变化,不随浓度压强等因素变化。A.升高温度,平衡正向进行,平衡常数增大,故A正确;B.增大压强,平衡不移动,平衡常数不变,故B错误;C.充入一定量CO2,平衡正向进行,但平衡常数K=![]() ,只随温度变化,温度不变,平衡常数不变,故C错误;D.再加入一定量铁粉,平衡不移动,平衡常数不变,故D错误;故答案为:A。
,只随温度变化,温度不变,平衡常数不变,故C错误;D.再加入一定量铁粉,平衡不移动,平衡常数不变,故D错误;故答案为:A。

【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。