题目内容
【题目】请按要求回答下列问题。
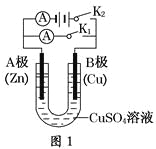
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
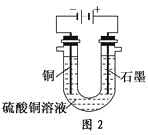
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
【答案】锌不断溶解 Cu2++2e-=Cu 锌极镀上一层红色的铜 Cu-2e-=Cu2+ 4OH--4e-=2H2O+O2↑ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 0.175a
2Cu+O2↑+4H+ 0.175a
【解析】
(1)①断开K2,闭合K1,则构成原电池,Zn为负极,失去电子变为Zn2+进入溶液;Cu为正极,其电极反应式为Cu2++2e-=Cu;
②断开K1,闭合K2,则构成电解池,A极为阴极,有红色铜在Zn极表面析出;B极为阳极,Cu失去电子变成Cu2+进入溶液,电极反应为Cu-2e-=Cu2+;
(2)③图2中石墨为阳极,其电极反应式为4OH--4e-=2H2O+O2↑,总电解反应式为
2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
④根据转移电子守恒得:![]() ×2=
×2=![]() ×4,V=0.175a L。
×4,V=0.175a L。

 阅读快车系列答案
阅读快车系列答案【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。