题目内容
【题目】某小组同学欲探究NH3催化氧化反应,按如图装置进行实验。
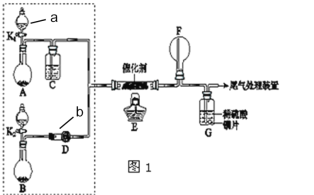
已知A、B装置可选药品:浓氨水、H2O2、蒸馏水、生石灰、MnO2。
(1)仪器a的名称为___;仪器b的名称为___。
(2)装置A烧瓶中固体的作用为___(填序号)
A.催化剂 B.氧化剂 C.还原剂 D.反应物
(3)仪器b中盛放的试剂可以是____(填序号)
A.浓硫酸 B.碱石灰 C.五氧化二磷 D.硫酸铜
(4)装置E中发生反应的化学方程式____。
(5)甲乙两同学分别按上述装置进行实验,一段时间后。
①甲观察到装置F中只有白烟生成,白烟的成分是___(写化学式)。
②乙观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:___;
(6)为帮助甲实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。你的改进措施是___。
【答案】分液漏斗 干燥管 A B 4NH3+5O2![]() 4NO+6H2O NH4NO3 3Cu+8H++2NO3=3Cu2++2NO↑+4H2O 增加 A中的产气量,减少装置B中的产气量
4NO+6H2O NH4NO3 3Cu+8H++2NO3=3Cu2++2NO↑+4H2O 增加 A中的产气量,减少装置B中的产气量
【解析】
该实验目的是探究氨的催化氧化反应,结合实验装置,装置A为制备氧气,装置A烧瓶中固体的作用为制取氧气用到的二氧化锰;装置B为制备氨气,氨气需要用固体碱石灰干燥;装置E中发生反应NH3催化氧化;装置F中生成的一氧化氮和氧气转化成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,白烟是由于氨气和硝酸反应生成了白色的NH4NO3固体,装置F中有红棕色气体,即二氧化氮气体,在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,金属铜和硝酸反应生成蓝色硝酸铜溶液,据此分析解答。
(1)仪器a的名称为分液漏斗;仪器b的名称为干燥管;
故答案为:分液漏斗;干燥管;
(2)A中制备气体为氧气,装置A烧瓶中固体的作用为制取气体用到的二氧化锰,利用过氧化氢制取氧气实验中,加入二氧化锰做催化剂加快产生氧气速率,
故答案为:A;
(3)B中制备气体为氨气,氨气中混有水蒸气,需要用固体碱石灰干燥,所以仪器b中盛放的试剂为碱石灰,
故答案为:B;
(4)4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(5)①装置F中生成的一氧化氮和氧气转化成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,白烟是由于氨气和硝酸反应生成了白色的NH4NO3固体,
故答案为:NH4NO3;
②装置F中有红棕色气体,即二氧化氮气体,在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO,获得硝酸,金属铜和硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O实质是:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O;
(6)为了氧化氨气,氧气需过量,为帮助甲实现在装置F中也观察到红棕色气体,需增加氧气的量,减少氨气的量,A为制氧气的装置,则增加 A中的产气量,减少装置B中的产气量,
故答案为:增加 A中的产气量,减少装置B中的产气量。

【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。