题目内容
3.室温下,下列叙述正确的是( )| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
分析 A、对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
B、根据等浓度等体积的碳酸钠、碳酸氢钠溶液中的物料守恒、电荷守恒判断;
C、等浓度、等体积的Na2CO3和NaHCO3混合,碳酸根离子的浓度大于碳酸氢根离子的水解程度,离子浓度大小顺序为c(HCO3-)>c(CO32-)>c(H2CO3),由此分析解答;
D、氯离子浓度抑制了氯化银的溶解,则氯离子浓度越大,银离子浓度越小.
解答 解:A、对应酸的酸性越弱,酸根离子的水解程度越强,溶液的pH越大,已知酸性:c(CH3COOH)>c(H2CO3)>c(C6H5OH),所以水解程度:C6H5ONa>NaHCO3>CH3COONa,pH相同时,溶液的浓度:C6H5ONa<NaHCO3<CH3COONa,三份溶液中的c(Na+):①>②>③,故A错误;
B、0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合后的溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒:2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-),二者结合可得:2c(OH-)-2c(H+)=-3c(H2CO3)+c(HCO3-)-c(CO32-),故B正确;
C、碳酸根离子的浓度大于碳酸氢根离子的水解程度,离子浓度大小顺序为c(HCO3-)>c(CO32-)>c(H2CO3),所以等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>1,而$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$<1,即:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$,故C错误;
D、将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸中溶解至饱和,氯离子浓度越大,则氯化银的溶解度越小,溶液中银离子浓度越小,三种溶液中氯离子浓度大小为:②>③>①,则c(Ag+)大小为:②>③>①,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及酸碱混合的定性判断及溶液pH的计算、难溶物溶解平衡及其应用、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
| A. | 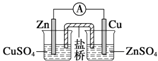 装置:构成锌-铜原电池 | |
| B. | 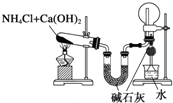 装置:实验室制氨气并收集干燥的氨气 | |
| C. | 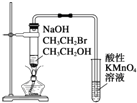 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 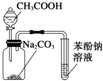 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
| A. |  点燃酒精灯 | B. |  向容量瓶转移液体 | ||
| C. |  读取液体体积 | D. |  加热液体 |
| A. | K+、H+、ClO-、I- | B. | Fe3+、Mg2+、NO3-、CO32- | ||
| C. | K+、Ca2+、HCO3-、OH- | D. | Al3+、NH4+、Cl-、SO42- |
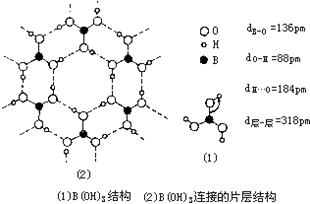 硼及其化合物在现代工业、生活和国防中有重要应用价值.
硼及其化合物在现代工业、生活和国防中有重要应用价值.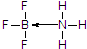 .
.