题目内容
18.W、M、X、Y、Z是四种短周期元素,M、X、Y处于同一周期,X的主族序数是周期序数的2倍,Y2-、Z+、W2+、M-的电子层结构相同,下列说法正确的是( )| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
分析 W、M、X、Y、Z是五种短周期元素,Y2-、Z+、W2+、M-的电子层结构相同,则Y、M处于第二周期,Z、W处于第三周期,结合离子电荷,可知Y为O元素、Z为Na、W为Mg、M为F元素,M、X、Y处于同一周期,即处于第二周期,X的主族序数是周期序数的2倍,即处于ⅣA族,故X为C元素,据此解答.
解答 解:W、M、X、Y、Z是五种短周期元素,Y2-、Z+、W2+、M-的电子层结构相同,则Y、M处于第二周期,Z、W处于第三周期,结合离子电荷,可知Y为O元素、Z为Na、W为Mg、M为F元素,M、X、Y处于同一周期,即处于第二周期,X的主族序数是周期序数的2倍,即处于ⅣA族,故X为C元素.
A.原子序数Mg>Na>F>O>C,即原子序数:W>Z>M>Y>X,故A错误;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Mg>C>O>F,即原子半径:Z>W>X>Y>M,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,故C错误;
D.非金属性F>O>C,氢化物稳定性与元素非金属性一致,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周期律的考查,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
6.下列说法不正确的是( )
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
13.根据下列各图曲线表征的信息,得出的结论不正确的是( )
| A. | 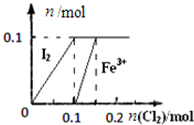 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 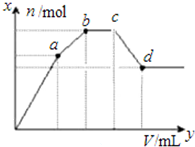 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |
3.室温下,下列叙述正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
10.25℃时,弱酸的电离平衡常数如下表,下列叙述不正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等体积、等物质的量浓度的CH3COOH溶液和Na2CO3溶液反应后的溶液呈碱性 | |
| B. | a mol/LHCN溶液与bmol/LNaOH溶液等体积混合,所得溶液c(Na+)>c(CN- ),则a可能等于b | |
| C. | 相同温度时,等物质的量浓度三种溶液的PH关系:NaCN>Na2CO3>CH3COONa | |
| D. | 向NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3- |
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位子周期表中第_VIII族,其基态原子的价层电子排布式为:3d64s2;
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
 已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.
已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大.A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素.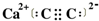 .
.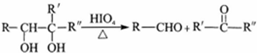
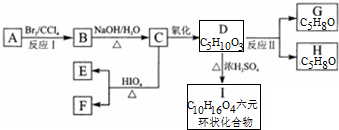
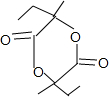 +2H2O.
+2H2O.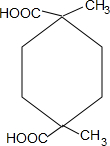 .
.