题目内容
13.下列措施,一定能使NaCl溶液中c(OH-)减小的是( )| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
分析 NaCl是强酸强碱盐,钠离子和氯离子都不水解,溶液显中性,
A、加热能够促进水的电离,溶液中氢离子浓度和氢氧根离子浓度都增大;
B、Na能够与水反应生成NaOH;
C、铵根离子水解,结合氢氧根离子;
D、以铁为电极电解NaCl溶液,阴极上氢离子放电.
解答 解:A、加热氢氧根离子浓度增大,故A错误;
B、Na与水反应生成NaOH,氢氧根离子浓度增大,故B错误;
C、氯化铵溶液显酸性,因为铵根离子水解,结合氢氧根离子,导致氢氧根离子浓度减小,故C正确;
D、以铁为电极电解NaCl溶液,阴极上氢离子放电,氢离子浓度减小,氢氧根离子浓度增大,故D错误;
故选C.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意掌握影响水的电离的因素,注意题干条件,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
8.可逆反应在一定条件下达到化学反应限度时( )
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
1.表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |
3.室温下,下列叙述正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
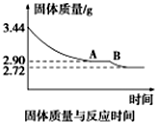
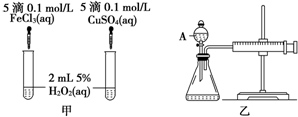 (1)下列反应属于吸热反应的是DE
(1)下列反应属于吸热反应的是DE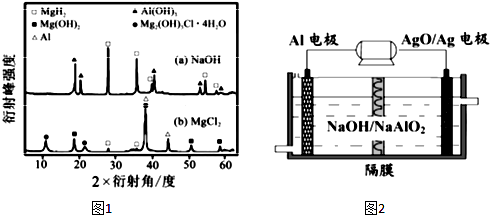
 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广.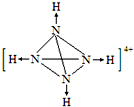 .
. 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: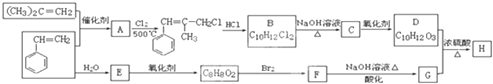
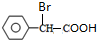 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$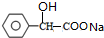 +NaBr+H2O.
+NaBr+H2O.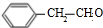 .
.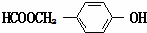 (写结构简式).
(写结构简式).