题目内容
15.下列实验操作正确的是( )| A. | 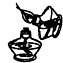 点燃酒精灯 | B. | 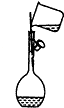 向容量瓶转移液体 | ||
| C. | 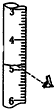 读取液体体积 | D. | 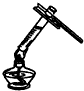 加热液体 |
分析 A、不能用燃着的酒精灯来引燃酒精灯;
B、向容量瓶转移液体时一定要用玻璃棒引流;
C、在读取溶液体积时视线要与凹液面平视;
D、给试管中的液体加热时,液体的量不能超过试管的$\frac{1}{3}$.
解答 解:A、不能用燃着的酒精灯来引燃酒精灯,容易引发火灾,故A错误;
B、向容量瓶转移液体时一定要用玻璃棒引流,否则溶液洒出后会导致溶质的损失,故B正确;
C、在读取溶液体积时视线要与凹液面平视,不能仰视,会导致溶液体积偏小,故C错误;
D、给试管中的液体加热时,液体的量不能超过试管的$\frac{1}{3}$,否则容易导致溶液溅出伤人,故D错误.
故选B.
点评 本题考查了常见的实验操作的正误判断,应注意的是给试管中的液体加热时,液体的量不能超过试管的$\frac{1}{3}$.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
3.室温下,下列叙述正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
10.25℃时,弱酸的电离平衡常数如下表,下列叙述不正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等体积、等物质的量浓度的CH3COOH溶液和Na2CO3溶液反应后的溶液呈碱性 | |
| B. | a mol/LHCN溶液与bmol/LNaOH溶液等体积混合,所得溶液c(Na+)>c(CN- ),则a可能等于b | |
| C. | 相同温度时,等物质的量浓度三种溶液的PH关系:NaCN>Na2CO3>CH3COONa | |
| D. | 向NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3- |
20.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位子周期表中第_VIII族,其基态原子的价层电子排布式为:3d64s2;
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
4.在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)═3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同n(NH3)/n(SO2)下,温度与SO2的转化率关系如图,下列说法正确的是( )

| A. | 脱硫反应△H<0 | |
| B. | n(NH3)/n(SO2):a<b<c | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | 及时从体系中除去水,平衡常数增大 |
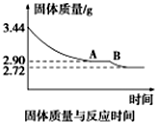 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: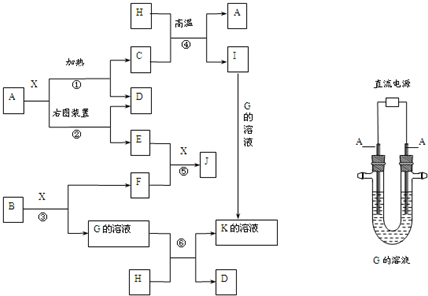
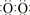 ]2-Na+
]2-Na+