题目内容
12.下列离子在溶液中能大量共存的一组是( )| A. | K+、H+、ClO-、I- | B. | Fe3+、Mg2+、NO3-、CO32- | ||
| C. | K+、Ca2+、HCO3-、OH- | D. | Al3+、NH4+、Cl-、SO42- |
分析 A.次氯酸根离子具有强氧化性,能够氧化碘离子;次氯酸根离子与氢离子结合生成次氯酸;
B.铁离子与碳酸根离子发生双水解反应;
C.碳酸氢根离子与氢氧根离子、钙离子反应生成碳酸钙沉淀;
D.四种离子之间不反应,能够大量共存.
解答 解:A.ClO-与H+、I-发生反应,在溶液中不能大量共存,故A错误;
B.Fe3+、CO32-之间发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,在溶液中不能大量共存,故B错误;
C.Ca2+、HCO3-、OH-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故C错误;
D.Al3+、NH4+、Cl-、SO42-之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
3.室温下,下列叙述正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
20.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位子周期表中第_VIII族,其基态原子的价层电子排布式为:3d64s2;
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
17.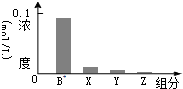 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
 室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液显中性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
4.在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)═3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同n(NH3)/n(SO2)下,温度与SO2的转化率关系如图,下列说法正确的是( )

| A. | 脱硫反应△H<0 | |
| B. | n(NH3)/n(SO2):a<b<c | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | 及时从体系中除去水,平衡常数增大 |
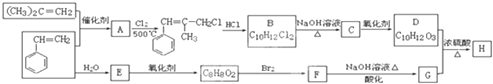
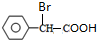 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$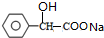 +NaBr+H2O.
+NaBr+H2O.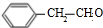 .
.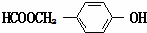 (写结构简式).
(写结构简式).
 .
.
 .
.