题目内容
11.下列关于各实验装置图的叙述中正确的是( )| A. | 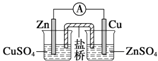 装置:构成锌-铜原电池 | |
| B. | 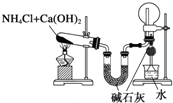 装置:实验室制氨气并收集干燥的氨气 | |
| C. | 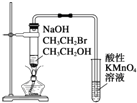 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 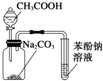 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
分析 A.电极与电解质溶液颠倒;
B.NH4Cl与Ca(OH)2 加热得到NH3,氨气可用碱石灰干燥,密度比空气小,易溶于水;
C.不能排出乙醇的影响;
D.生成的二氧化碳含有乙酸.
解答 解:A.应将锌插入硫酸锌,铜插入硫酸铜溶液中,否则锌置换铜,不能形成原电池反应,故A错误;
B.NH4Cl与Ca(OH)2 加热得到NH3,碱石灰干燥NH3,圆底烧瓶干燥收集NH3,水处理多余NH3,故B正确;
C.乙醇易挥发,其能与酸性高锰酸钾溶液反应,应先除去乙醇,故C错误;
D.乙酸和碳酸钠溶液反应生成二氧化碳气体,生成的二氧化碳含有乙酸,不能证明酸性H2CO3>C6H5OH,故D错误.
故选B.
点评 本题考查化学实验方案的评价,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握实验的原理以及实验操作的严密性的判断,难度不大.

练习册系列答案
相关题目
1.表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |
19.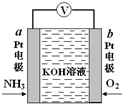 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中OH-向电极a移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | O2在电极b上发生还原反应 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2↑+6H2O |
6.下列说法不正确的是( )
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
16. 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
 某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )
某恒密闭容器中,一定量的X与Y发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述中正确的是( )| A. | 反应温度T1>T2该反应是吸热反应 | |
| B. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| C. | M点的平衡常数比W点的平衡常数小 | |
| D. | M点时再加入一定量的X,平衡后X的转化率增大 |
3.室温下,下列叙述正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>① | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水 ②10mL 0.2mol/L MgCl2 ③20mL 0.3mol/L盐酸 中溶解至饱和c(Ag+):①>②>③ |
20.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 硅酸凝胶经干燥脱水后得到“硅胶”,常用作干燥剂,也可以用作催化剂的载体 | |
| B. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| C. | 煤与氢气作用生成液体燃料,也可以间接液化,先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇 | |
| D. | 含氮和磷的大量污水任意排放向近海海域会出现水华、赤潮等污染问题 |
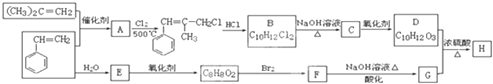
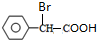 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$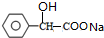 +NaBr+H2O.
+NaBr+H2O.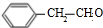 .
.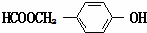 (写结构简式).
(写结构简式).