题目内容
【题目】某课题组同学受葡萄糖与新制氢氧化铜悬浊液反应实验的启示,拟设计实验利用氧化铜探究乙醛的还原性。
【提出猜想】 猜想 1: CH3CHO+2CuO ![]() CH3COOH+Cu2O;
CH3COOH+Cu2O;
猜想 2:_______________________ (写出化学方程式)。
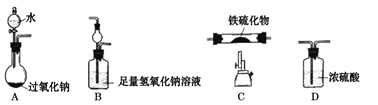
【定性实验】(1)甲同学设计下图装置进行实验(部分夹持装置已略去):

已知: 乙醛和乙酸的沸点分别为 20.8℃、 117.9℃。
按上述装置进行实验,当氧化铜完全反应后停止实验。
①为达到良好的冷凝效果,方框中 C 装置应选用_________(填仪器名称);实验中先通入乙醛蒸气,后点燃装置 B 处酒精灯,这样操作的目的是_________。
②已知: Cu2O 呈红色,在酸性条件下发生反应 Cu2O+2H+=Cu+Cu2++H2O。 请你设计实验证明猜想 1 成立。
实验操作:____________________________________ 。
实验现象:____________________________________ 。
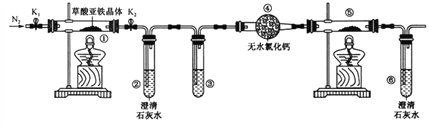
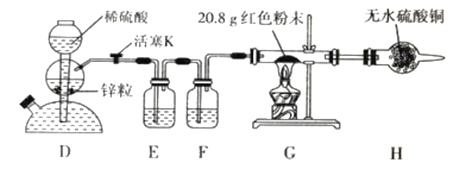
【定量实验】(2)乙同学设计了如下图所示实验方案定量探究红色固体的成分。
已知:醋酸亚铬[Cr(CH3COO)2]溶液可以吸收少量的 O2。
①下列有关说法正确的是(填标号)_______ 。
a. 装置 D 可以控制反应的发生与停止
b. 装置 F 中盛装醋酸亚铬溶液
c. 向装置 D 中加入少量硫酸铜固体可加快反应
d. 实验中观察到装置 G 中有明显现象
②装置 G 中红色粉末完全反应后,称得固体粉末质量为 19.2 g;装置 H 净增质量为2.0 g。请选择合理数据计算,确定红色粉末的成分及物质的量: _______。
【答案】 CH3CHO+CuO![]() CH3COOH+Cu 直形冷凝管 排尽装置中的空气,防止乙醛被氧气氧化 取B中固体少许于试管中,加入适量稀硫酸震荡 溶液变成蓝色,有红色固体残余(见溶液变蓝色给可) ac 0.1 mol Cu2O,0.1 mol Cu
CH3COOH+Cu 直形冷凝管 排尽装置中的空气,防止乙醛被氧气氧化 取B中固体少许于试管中,加入适量稀硫酸震荡 溶液变成蓝色,有红色固体残余(见溶液变蓝色给可) ac 0.1 mol Cu2O,0.1 mol Cu
【解析】该实验的目的是:利用氧化铜探究乙醛的还原性,根据猜想 1: CH3CHO+2CuO ![]() CH3COOH+Cu2O;乙醛将氧化铜还原为氧化亚铜,故可以猜想,乙醛将氧化铜还原为铜。观察装置,A中产生乙醛蒸汽,进入B发生反应,在M处收集乙酸,故C装置的作用是冷凝。
CH3COOH+Cu2O;乙醛将氧化铜还原为氧化亚铜,故可以猜想,乙醛将氧化铜还原为铜。观察装置,A中产生乙醛蒸汽,进入B发生反应,在M处收集乙酸,故C装置的作用是冷凝。
猜想二:若乙醛将氧化铜还原为铜的话,方程式应为:CH3CHO+CuO![]() CH3COOH+Cu;
CH3COOH+Cu;
①C 装置要起到冷凝效果,应选用直形冷凝管;应为乙醛容易被氧化,所以实验中先通入乙醛蒸气,后点燃装置 B 处酒精灯,这样操作的目的是排尽装置中的空气,防止乙醛被氧气氧化;
②要证明猜想 1 成立,即证明产物是Cu2O,根据反应Cu2O+2H+=Cu+Cu2++H2O,故取B中固体少许于试管中,加入适量稀硫酸振荡,溶液变成蓝色,且有红色固体残余,即证明证明产物是Cu2O;
(2)要定量探究红色固体的成分,观察装置,此实验的原理即是用氢气还原红色固体,通过测量粉末质量的变化,测定红色固体中氧的含量。
①a.启普发生器可以控制反应的开始与停止,故a正确;b. 装置 F 中应盛放的是浓硫酸吸收氢气中的水蒸气,不需要吸收氧气,开始前就应该将装置内空气全部排出,故b错误; c. 向装置 D 中加入少量硫酸铜固体可形成铜锌原电池可加快反应,故c正确;d.装置 G 中,氢气还原氧化亚铜得到铜依然是红色的,故没有明显现象,故d错误,故选ac;
②H中的增重还包括空气中的水分等,故2.0g不能用,完全反应后,称得固体粉末质量为 19.2 g,反应前后粉末减少1.6g,即粉末中m(O)=1.6g,n(O)=0.1mol,m(Cu)=19.2g,n(Cu)=0.3mol,故该粉末不全是Cu2O,还应该有Cu,n(Cu2O)=0.1mol,n(Cu)=0.1mol。

【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1