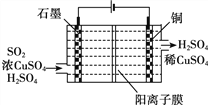
题目内容
【题目】下列化学用语表达正确的是
A. Na2O2的电子式:![]()
B. Al3+的结构示意图:![]()
C. CH3COOCH3的名称:乙酸甲酯
D. 用电子式表示氯化氢的形成过程:![]() +
+![]() →
→![]()
【答案】C
【解析】A.根据过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物分析判断;B.根据铝离子为失去最外层3个电子,达到最外层8个电子的稳定结构分析判断;C.根据CH3COOCH3的结构简式结合酯的命名分析判断;D.根据氯化氢是共价化合物分析判断。
A.过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为![]() ,故A错误;B.铝离子核外有2个电子层且最外层有8个电子,据此书写铝离子的结构示意图为
,故A错误;B.铝离子核外有2个电子层且最外层有8个电子,据此书写铝离子的结构示意图为![]() ,故B错误;C.CH3COOCH3是乙酸甲酯的结构简式,故C正确;D.氯化氢为共价化合物,氯化氢分子中不存在阴阳离子,用氯化氢的形成过程为:
,故B错误;C.CH3COOCH3是乙酸甲酯的结构简式,故C正确;D.氯化氢为共价化合物,氯化氢分子中不存在阴阳离子,用氯化氢的形成过程为:![]() ,故D错误;故选C。
,故D错误;故选C。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=206.1kJmol﹣1
②CH4(g)+CO2(g)2CO(g)+2H2(g)△H2=247.3kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . 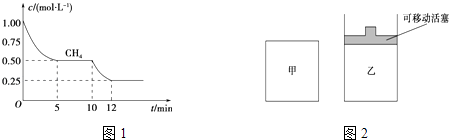
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变. ①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3= kJmol﹣1 . 800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.