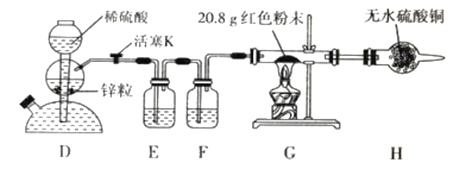
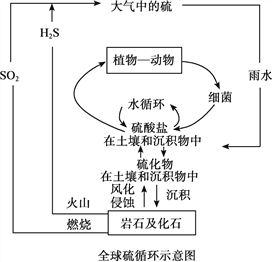
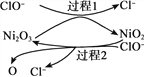
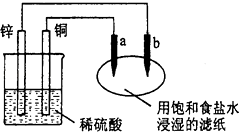
题目内容
【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1
【答案】C
【解析】根据表格数据分析出反应速率与c(HI)和c(H2O2)浓度的关系后再分析判断。
根据表格数据可以看出,实验2与实验1比较,c(HI)增大到原来的2倍,则反应速率也增大原来的2倍,实验4与实验1比较,c(H2O2)原来的2倍,则反应速率也变成原来的2倍,实验3与实验1比较,c(HI)和c(H2O2)都增大原来的1.5倍,则反应速率增大到原来的1.5×1.5=![]() =2.25倍,则可以得出反应速率与c(HI)和c(H2O2)浓度变化成正比,所以实验5反应速率是实验1的
=2.25倍,则可以得出反应速率与c(HI)和c(H2O2)浓度变化成正比,所以实验5反应速率是实验1的![]() =3倍,则c(HI)和c(H2O2)之积应该增大到原来的3倍,所以A、B、D符合,C不符合,故选C。
=3倍,则c(HI)和c(H2O2)之积应该增大到原来的3倍,所以A、B、D符合,C不符合,故选C。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】含氮化合物在工农业生产中都有重要应用。
(1)肼(N2H4)与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g/L,且其中氮元素的质量分数为0.977,则该反应的化学方程式为____.
(2)二氧化氮在一定条件下,可以发生如下反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
实验编号 | 温度 | 起始物质的量mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4.0 | 1.0 | 0.9 |
乙 | T2 | 1.0 | 4.0 | 0.8 |
丙 | T2 | 0.4 | 0.6 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,0~2min时间内,用SO2表示的平均反应速率v(SO2)=_______________,该温度下的平衡常数为_________。(结果保留到小数点后两位)
②由表中数据可推知:T1_______T2(填“>”“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为______________.
(3)工业上可以用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。室温下测得NH4HSO3溶液pH为6,则溶液的![]() ________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
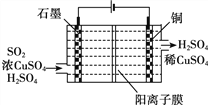
(4)使用间接电化学法可以处理煤烟气中的NO,装置如图,已知电解池溶液的pH在4~7之间,写出阴极的电极反应式__________________。
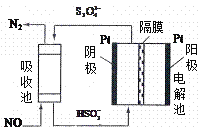 。
。
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .