题目内容
【题目】我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂D.海域天然气水合物试采连续60天
【答案】B
【解析】
2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖;
故选B。

【题目】含氮化合物在工农业生产中都有重要应用。
(1)肼(N2H4)与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g/L,且其中氮元素的质量分数为0.977,则该反应的化学方程式为____.
(2)二氧化氮在一定条件下,可以发生如下反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
实验编号 | 温度 | 起始物质的量mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4.0 | 1.0 | 0.9 |
乙 | T2 | 1.0 | 4.0 | 0.8 |
丙 | T2 | 0.4 | 0.6 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,0~2min时间内,用SO2表示的平均反应速率v(SO2)=_______________,该温度下的平衡常数为_________。(结果保留到小数点后两位)
②由表中数据可推知:T1_______T2(填“>”“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为______________.
(3)工业上可以用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。室温下测得NH4HSO3溶液pH为6,则溶液的![]() ________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
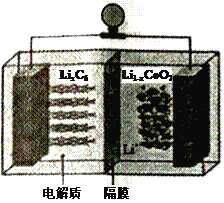
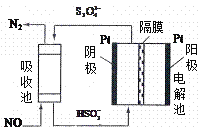
(4)使用间接电化学法可以处理煤烟气中的NO,装置如图,已知电解池溶液的pH在4~7之间,写出阴极的电极反应式__________________。
 。
。