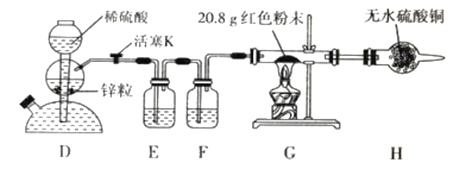
题目内容
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 常温常压下28g N2所含电子数为10NA
B. 46g 钠充分燃烧时转移电子数为2NA
C. 0.1mol/L NH4Cl溶液中NH4+离子数小于0.1NA
D. 密闭容器中3mol NO与1molO2充分反应,剩余气体的分子数为3NA
【答案】B
【解析】A.1个N2含有2个N,14个e-,常温常压下,28g氮气的物质的量为![]() =1mol,含有的核外电子数为14NA,故A错误;B.46 g钠充分燃烧时转移电子数为
=1mol,含有的核外电子数为14NA,故A错误;B.46 g钠充分燃烧时转移电子数为![]() ×(1-0)×NA=2NA,故B正确;C、未告知溶液的体积,无法计算溶液中的铵根离子的个数,故C错误;D、3molNO与1molO2充分反应生成2molNO2后,剩余1molNO,NO2存在平衡:2NO2N2O4,导致分子个数减少,故D错误;故选B。
×(1-0)×NA=2NA,故B正确;C、未告知溶液的体积,无法计算溶液中的铵根离子的个数,故C错误;D、3molNO与1molO2充分反应生成2molNO2后,剩余1molNO,NO2存在平衡:2NO2N2O4,导致分子个数减少,故D错误;故选B。

【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=206.1kJmol﹣1
②CH4(g)+CO2(g)2CO(g)+2H2(g)△H2=247.3kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . 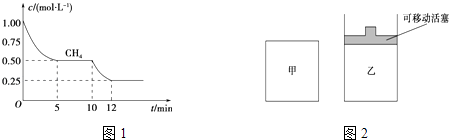
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变. ①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3= kJmol﹣1 . 800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。