题目内容
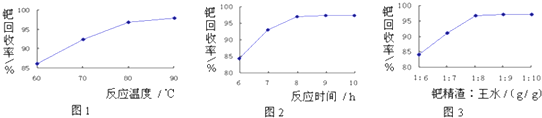
18.用如图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下:
| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
(2)若发现C中气泡产生过猛,需要进行的操作的关键是用分液漏斗控制滴加液体的量或滴加速率.
(3)前期P过量生成三氯化磷,后期氯气过量生成五氯化磷,从PCl3和PCl5的混合物中分离出PCl3的最佳方法是a(选填序号).
a.蒸馏 b.分液 c.升华
(4)生成的PCl3在G中收集,则F中盛有冷水,作用是使得三氯化磷液化.
(5)C、D、H所盛的试剂分别是:C饱和食盐水;D浓硫酸;H碱石灰.
(6)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是五氯化磷蒸汽冷却后变成固体.
分析 (1)检查装置的气密性装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡;
(2)调节浓盐酸的加入速度使反应缓慢些;
(3)Cl2逐渐过量,会将PCl3氧化成PCl5;虽然PCl3是液态,而PCl5是固态,但在加热时都是温度超过75℃,此时PCl3是气态,而PCl5是液态,可以蒸馏分开;
(4)气态的PCl3到G中要液化生成液态,F装置起到降温作用,所以F中要加入冷水;
(5)除去氯气中的氯化氢用饱和的食盐水,浓硫酸作干燥剂,在E装置中P和Cl2发生反应,G中收集PCl3,H是防止空气中水蒸气进入G,使PCl3水解;
(6)如果E中放热多,PCl5也可能汽化,在导管中易凝华而堵塞导气管;
解答 解:(1)检查整套装置的气密性,首先要密闭装置,H接一导管放入水槽,将H浸入水中,然后微热圆底烧瓶B,在其他各盛液体的仪器中观察是否有气泡,然后停止加热,过一会儿看H的导管中会倒吸形成一段水柱,说明气密性良好,
故答案为:H接一导管放入水槽,然后微热圆底烧瓶B,若导管口产生气泡,撤灯后导管中形成水柱,说明装置气密性良好;
(2)C中产生气泡过猛,说明反应产生的Cl2太快,需要调节浓盐酸的加入速度,
故答案为:用分液漏斗控制滴加液体的量或滴加速率;
(3)虽然PCl3是液态,而PCl5是固态,但在加热时都是温度超过75℃,此时PCl3是气态,而PCl5是液态,可以蒸馏分开,
故答案为:a;
(4)气态的PCl3到G中要液化生成液态,F装置起到降温作用,所以F中要加入冷水,
故答案为:冷水;使得三氯化磷液化;
(5)从B装置产生的Cl2中混有HCl,先通过饱和食盐水除去,然后通入浓硫酸干燥,在E装置中P和Cl2发生反应,G中收集PCl3,H是防止空气中水蒸气进入G,使PCl3水解,
故答案为:饱和食盐水;浓硫酸;碱石灰;
(6)如果E中放热多,PCl5也可能汽化,在导管中易凝华而堵塞导气管,
故答案为:五氯化磷蒸汽冷却后变成固体.
点评 本题考查了制备实验方案的设计与理解、阅读题目获取信息的能力、元素化合物的性质等,难度不大,是对知识的综合运用和能力考查,注意基础知识的积累.

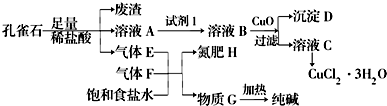
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
 .
.

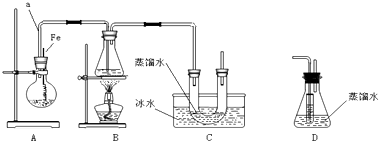
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$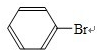 +HBr
+HBr