题目内容
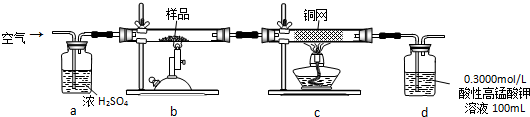
13.四氯化硅是粗硅精炼中的中间产物:熔点-70℃,沸点57.6℃,在潮湿空气中水解生成硅酸和氯化氢.某兴趣小组在实验室里通过如图所示装置制取少量四氯化硅:
(1)如何检验如图气体发生装置的气密性:堵住导管出口,打开分液漏斗活塞,向分液漏斗中注入蒸馏水,过一会,如果分液漏斗中液面不再下降,则气密性良好;
(2)A装置中发生反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)A装置中玻璃实验仪器名称为(写出两种即可):分液漏斗和圆底烧瓶;
(4)B中的液体为:饱和食盐水,F中碱石灰的作用为:①吸收多余氯气②防止空气中水蒸气从末端进入D中
(5)先加热图中哪个装置:A原因:利用A所产生的氯气排尽装置中的空气等,防止硅与空气反应若实验中用12mol•L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:随着反应进行,浓盐酸会变稀,稀盐酸不和二氧化锰反应.
分析 本实验用浓盐酸与二氧化锰反应生成氯气,随着反应的进行,浓盐酸变稀后反应就会停止,由于氯气中有氯化氢和水杂质,所以用饱和食盐水和浓硫酸除杂,要先除氯化氢后除水,除杂后的氯气与硅反应生成四氯化硅,未反应的氯气有毒,所以用碱石灰吸收尾气,同时碱石灰还可以防止空气中的水分进入装置与四氯化硅反应,由于空气中的水分与四氯化硅会反应,所以在反应的开始用氯气将装置中的空气排尽,据此答题.
解答 解:本实验用浓盐酸与二氧化锰反应生成氯气,随着反应的进行,浓盐酸变稀后反应就会停止,由于氯气中有氯化氢和水杂质,所以用饱和食盐水和浓硫酸除杂,要先除氯化氢后除水,除杂后的氯气与硅反应生成四氯化硅,未反应的氯气有毒,所以用碱石灰吸收尾气,同时碱石灰还可以防止空气中的水分进入装置与四氯化硅反应,由于空气中的水分与四氯化硅会反应,所以在反应的开始用氯气将装置中的空气排尽,
(1)根据实验装置图可知,检验装置的气密性的方法是堵住导管出口,打开分液漏斗活塞,向分液漏斗中注入蒸馏水,过一会,如果分液漏斗中液面不再下降,则气密性良好,
故答案为:堵住导管出口,打开分液漏斗活塞,向分液漏斗中注入蒸馏水,过一会,如果分液漏斗中液面不再下降,则气密性良好;
(2)A装置中是浓盐酸与二氧化锰反应生成氯气,反应的离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)根据实验装置图可知,A装置中玻璃实验仪器有分液漏斗、圆底烧瓶、酒精灯,
故答案为:分液漏斗;圆底烧瓶;
(4)根据上面的分析可知,B中的液体为饱和食盐水,F中碱石灰的作用为①吸收多余氯气,②防止空气中水蒸气从末端进入D中,
故答案为:饱和食盐水;吸收多余氯气;防止空气中水蒸气从末端进入D中;
(5)由于实验中要先将装置中的空气排尽,防止硅与空气反应,所以先加热图中A装置,随着反应进行,浓盐酸会变稀,稀盐酸不和二氧化锰反应,所以若实验中用12mol•L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,
故答案为:A;利用A所产生的氯气排尽装置中的空气等,防止硅与空气反应;随着反应进行,浓盐酸会变稀,稀盐酸不和二氧化锰反应.
点评 本题考查制备实验方案的设计,综合了氯气的制法、除杂、尾气吸收等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

| A.元素原子的核外p电子总数比s电子总数少1 |
| B.元素价电子排布式为nsnnp2n |
| C.元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| D.原子核外所有p轨道全满或半满 |
| E.元素的主族序数与周期数的差为4 |
| F.是前四周期中电负性最小的元素 |
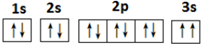
(2)某同学根据上述信息,所画的C电子排布图如图违背了泡利 原理.
(3)DE3 中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形.检验F元素的方法是焰色反应.
(4)A2与B22+互为等电子体,B22+的电子式可表示为
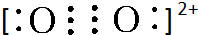 ;1mol B22+中含有的π键数目为2NA.
;1mol B22+中含有的π键数目为2NA.(5)下列电子云图象均为成键后电子云图象,其中可表示一个E原子与一个E原子的是E,表示一个氢原子与一个E原子的是D.


| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
(2)若发现C中气泡产生过猛,需要进行的操作的关键是用分液漏斗控制滴加液体的量或滴加速率.
(3)前期P过量生成三氯化磷,后期氯气过量生成五氯化磷,从PCl3和PCl5的混合物中分离出PCl3的最佳方法是a(选填序号).
a.蒸馏 b.分液 c.升华
(4)生成的PCl3在G中收集,则F中盛有冷水,作用是使得三氯化磷液化.
(5)C、D、H所盛的试剂分别是:C饱和食盐水;D浓硫酸;H碱石灰.
(6)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是五氯化磷蒸汽冷却后变成固体.
| A. | 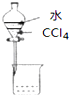 分离水和CCl4 | B. | 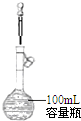 定容 | ||
| C. | 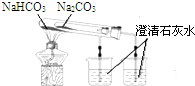 比较两种盐的热稳定性 | D. |  构成铜锌原电池 |