题目内容
6.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图所示.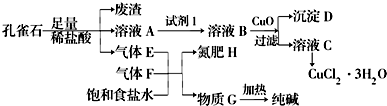
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
分析 向孔雀石中加入足量稀盐酸,发生的反应有Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,铁的氧化物溶于稀盐酸生成铁盐、亚铁盐和水,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及CuCl2,气体E为CO2,将气体CO2、气体F和饱和食盐水混合得到氮肥H和物质G,根据元素守恒知F为NH3,氮肥H为NH4Cl,加热G得到纯碱,则G为NaHCO3;向溶液A中加入试剂1得到溶液B,向溶液B中加入CuO并过滤得到滤液C和沉淀D,从溶液C中能得到CuCl2.3H2O,则沉淀D应该含有铁元素,CuO的目的是调节溶液的pH,使Fe 3+转化为Fe(OH)3沉淀,根据元素守恒知,B中含有Fe3+、Cu2+,则试剂1的目的是将Fe2+转化为Fe3+且不能引进杂质,应该选取双氧水或氯水;
(1)根据以上分析E、H的化学式依次为CO2、NH4Cl;
(2)图中“试剂1”若为H2O2,能将Fe2+转化为Fe3+且不能引进杂质,以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全;
(3)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离,且不能沉淀氢氧化铜沉淀;
(4)从溶液中获取晶体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法得到较纯净的晶体,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗.
解答 解:(1)向孔雀石中加入足量稀盐酸,发生的反应有Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,E为气体为CO2,将气体CO2、气体F和饱和食盐水混合得到氮肥H和物质G,根据元素守恒知F为NH3,氮肥H为NH4Cl,
故答案为:CO2;NH4Cl;
(2)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+,图中“试剂1”选用H2O2,H2O2具有氧化性,在该反应中作氧化剂,亚铁离子具有还原性,发生H2O2+2Fe2++2H+=2Fe3++2H20,H2O2与Fe2+反应生成的H20为溶剂无污染,不会引入新的杂质离子,
故答案为:Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀.所以欲除去Cu2+中混有的Fe2+,利用双氧水(也可用氯气)先将其氧化为Fe3+.
(3)氢氧化物完全沉淀:Fe3+pH为3.2,氢氧化物开始沉淀Cu2+pH为4.7,加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离,且不能沉淀氢氧化铜沉淀,所以pH取值范围为3.2≤pH<4.7,
故答案为:3.2≤pH<4.7;
(4)为防止结晶水失水,结晶水合物通常采用降温结晶,由溶液C获得CuCl2•3H2O,从溶液中获取晶体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法得到较纯净的晶体,晶体的洗涤方法:向漏斗中加水至浸没晶体,待水自然流干后,再重复2-3次,洗涤CuCl2•3H2O晶体需要的主要玻璃仪器有烧杯、玻璃棒、漏斗,
故答案为:冷却结晶;玻璃棒、漏斗.
点评 本题考查物质制备及物质分离和提纯,为高考高频点,侧重考查学生分析、计算及实验操作能力,关键是明确实验原理及基本操作方法,知道流程图中发生的反应及操作方法是解答的关键,题目难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
(2)若发现C中气泡产生过猛,需要进行的操作的关键是用分液漏斗控制滴加液体的量或滴加速率.
(3)前期P过量生成三氯化磷,后期氯气过量生成五氯化磷,从PCl3和PCl5的混合物中分离出PCl3的最佳方法是a(选填序号).
a.蒸馏 b.分液 c.升华
(4)生成的PCl3在G中收集,则F中盛有冷水,作用是使得三氯化磷液化.
(5)C、D、H所盛的试剂分别是:C饱和食盐水;D浓硫酸;H碱石灰.
(6)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是五氯化磷蒸汽冷却后变成固体.
 ;
; ;指出分子中化学键是共价键(填‘离子键’或‘共价键’).
;指出分子中化学键是共价键(填‘离子键’或‘共价键’). 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
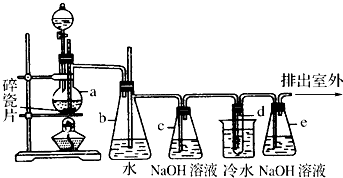
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).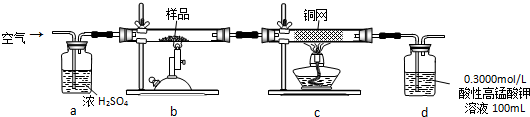
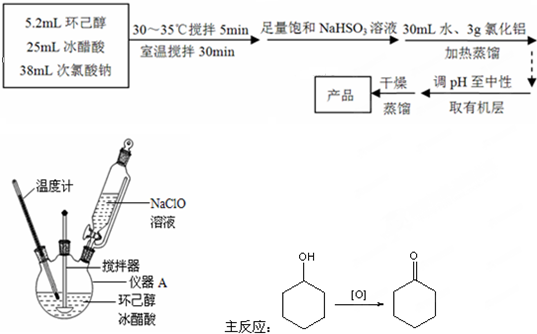
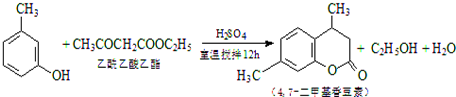
 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.