题目内容
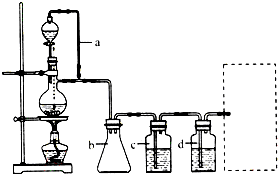
3.某课外活动小组将如图1所示装置按一定顺序连接,在实验室里制取一定量的FeCl3 (所通气体过量并充分反应)
请加答下列问题:
(1)如何检查A装置的气密性密闭导气管,打开分液漏斗的瓶塞,向漏斗中注入水,然后旋开旋塞,如水不能顺利滴下,气密性良好
(2)装置A中发生反应的化学方程式4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)各装置的正确连接顺序为(填写装置代号)
A→E→C→B→D
(4)装置C的作用是干燥Cl2防止FeCl3的水解
(5)反应开始后,装置B中硬质玻璃管内的现象为棕(红)色的烟;可以检验生成物中是否含有Fe3+ 的试剂是KSCN溶液
(6)该小组欲用如图所示装置收集尾气,并测量多余气体的体积.
①若量气装置如图2.此处所用的滴定管是碱式滴定管
②为了提高测量的准确性,如图装置中的液体可用饱和食盐水,收集完气体后,读数前应进行的操作是上下移动滴定管,使左右两边液面相平.
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测的体积偏大(填“偏大”、“偏小”、或“无影响”)
分析 (1)装置密闭,导气管关闭,改变烧瓶中的气体压强,打开分液漏斗活塞,加入水,看水是否顺利滴下来判断气密性;
(2)由装置图及药品可知,利用氯气与铁反应制取氯化铁.A中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(3)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
(4)氯气中含水会导致生成的氯化铁发生水解,得不到纯净的氯化铁;
(5)B中硬质玻璃管内氯气与铁反应生成氯化铁.用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色,说明含有Fe3+;
(6)①根据滴定管的结构判断;
②Cl2能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性;
读数时应使圆底烧瓶内外气压相等,故读数前应使左右两边液面相平;
③滴定管内测量前后溶液体积变化为气体体积,俯视时,读取的液面的数值比实际偏小.
解答 解:(1)密闭导气管,依据分液漏斗中水的流下与否设计检查装置气密性,检查A装置的气密性的方法为:密闭导气管,打开分液漏斗的瓶塞,向漏斗中注入水,然后旋开旋塞,如水不能顺利滴下,气密性良好,
故答案为:密闭导气管,打开分液漏斗的瓶塞,向漏斗中注入水,然后旋开旋塞,如水不能顺利滴下,气密性良好.
(2)A中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为A→E→C→B→D,故答案为:E;C;B.
(4)如果进入B的气体不干燥,FeCl3容易水解,装置C的作用是干燥Cl2,防止FeCl3的水解.
故答案为:干燥Cl2防止FeCl3的水解;
(5)B中硬质玻璃管内氯气与铁反应生成氯化铁,B中因生成有FeCl3而出现棕(红)色的烟;用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色,说明含有Fe3+,
故答案为:棕(红)色的烟;KSCN溶液;
(6)①酸式滴定管下端由活塞,装置中的滴定管没有活塞,应是碱式滴定管,
故答案为:碱式滴定管;
②Cl2能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性.应使圆底烧瓶内外气压相等,读数前应上下移动滴定管,使左右两边液面相平,
故答案为:饱和食盐水;上下移动滴定管,使左右两边液面相平;
③俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大,故答案为:偏大.
点评 本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来.考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等,(5)③为易错点,注意滴定管内测量前后溶液体积变化为气体体积,滴定管数值由上而下增大.


| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
(2)若发现C中气泡产生过猛,需要进行的操作的关键是用分液漏斗控制滴加液体的量或滴加速率.
(3)前期P过量生成三氯化磷,后期氯气过量生成五氯化磷,从PCl3和PCl5的混合物中分离出PCl3的最佳方法是a(选填序号).
a.蒸馏 b.分液 c.升华
(4)生成的PCl3在G中收集,则F中盛有冷水,作用是使得三氯化磷液化.
(5)C、D、H所盛的试剂分别是:C饱和食盐水;D浓硫酸;H碱石灰.
(6)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是五氯化磷蒸汽冷却后变成固体.

各离子开始沉淀和完全沉淀的pH值
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |
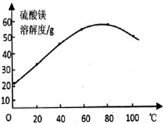
请回答下列问题:
(1)步骤①可在如图装置中进行,仪器A的名称是三颈烧瓶;
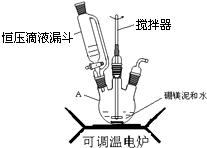
(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是速度快、得到的滤渣较干燥;
(3)步骤②中加硼镁泥的作用是消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀,NaClO的作用是氧化Fe2+、Mn2+;
(4)步骤③趁热过滤的目的是防止析出MgSO4•7H2O该过程中温度应控制在80℃左右;
(5)步骤④的具体操作:当出现晶膜时即停止加热,其原因是防止MgSO4•7H2O失去结晶水.
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).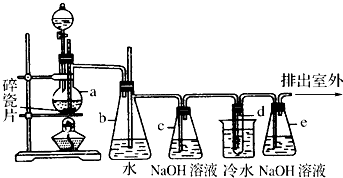
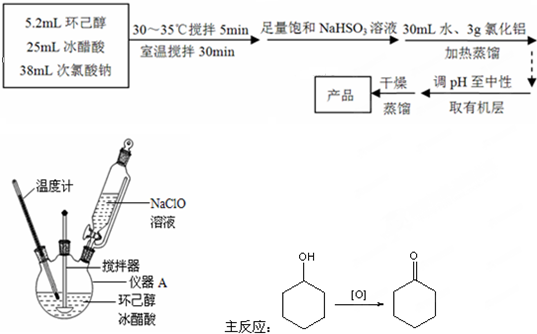
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: