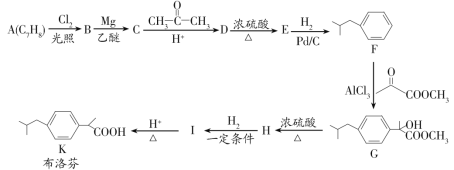
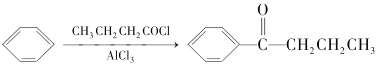
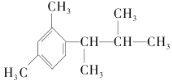
题目内容
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
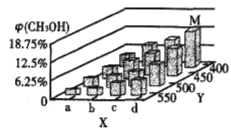
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【答案】-12 小于 随着Y值的增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度 BC 56% ![]() 1:5
1:5
>
【解析】
(1)设C―H的键能为xkJ/mol,反应CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)的△H=反应物总键能-生成物总键能=(3x+351+463+ 393×3- 3x- 293- 393×2-463×2)kJ/mol=-12 kJ/mol;
(2)①副反应反应前后气体分子数不变,若增大压强,主反应正向移动,CH3OH的体积分数增大,根据图示信息可判断,随着Y的增大CH3OH的体积分数减小,故X轴代表的是压强,X轴上a点的数值比b点小;随着Y值的增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度;
②Ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0,若反应Ⅱ的平衡常数K值变小,平衡常数只与温度有关,反应Ⅱ的正反应为放热反应,故平衡移动的原因是升高了温度,升高温度两个反应都逆向移动,容器中φ(CH3OCH3)减小,φ(CH3OH)也减小,所以正确的是BC;
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则n(CH3OCH3)=0.2mol,根据2CH3OH(g)CH3OCH3(g)+H2O(g),分解的CH3OH为0.4mol,生成的水为0.2 mol,设CO转化物质的量是x,则有:
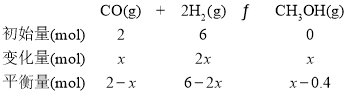
则![]() ,解得x=1.12mol,此时CO的转化率为;
,解得x=1.12mol,此时CO的转化率为;![]() ;用H2表示I的反应速率为:
;用H2表示I的反应速率为:![]() ;
;
(3)常温下,pH=11的溶液,其c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由![]() +H2O
+H2O![]()
![]() +OH-得,根据溶液
+OH-得,根据溶液![]() ,代入相关数据可计算出溶液中c(
,代入相关数据可计算出溶液中c(![]() )∶c(
)∶c(![]() )=1:5,由电荷守恒原理得:c(Na+)+c(H+)=c(
)=1:5,由电荷守恒原理得:c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),由于c(OH-)>c(H+),所以c(Na+)> c(
)+c(OH-),由于c(OH-)>c(H+),所以c(Na+)> c(![]() )+2c(
)+2c(![]() )。
)。

 每课必练系列答案
每课必练系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 原子最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)E元素在周期表中的位置是_________________________。
(2)写出D元素基态原子的简化电子排布式:__________。
(3)这5种元素中电负性最大的元素是__________(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________________(填元素符号)。
(4)B、C、D的简单离子的半径由大到小的顺序为____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式:_____________________。