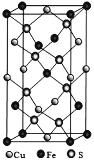
题目内容
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
【答案】D
【解析】
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]() 三者会发生氧化还原反应,且H+与SO
三者会发生氧化还原反应,且H+与SO![]() 也会反应生成H2O和SO2,一定不能大量共存,A不符合题意;
也会反应生成H2O和SO2,一定不能大量共存,A不符合题意;
B.pH=12的溶液中:OH-和HCO![]() 会反应生成H2O和
会反应生成H2O和![]() ,一定不能大量共存,B不符合题意;
,一定不能大量共存,B不符合题意;
C.加入铝粉能放出氢气的溶液可能是强酸性溶液也可能是强碱性溶液,NH![]() 在强碱性溶液中不能大量共存, AlO
在强碱性溶液中不能大量共存, AlO![]() 不能在强酸性溶液中大量共存,一定不能大量共存,C不符合题意;
不能在强酸性溶液中大量共存,一定不能大量共存,C不符合题意;
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+四种离子均为无色,均不水解,均不能反应,一定能够大量共存,D符合题意;
、K+四种离子均为无色,均不水解,均不能反应,一定能够大量共存,D符合题意;
故答案为:D。

 53随堂测系列答案
53随堂测系列答案【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
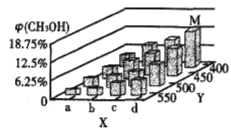
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。