题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L Cl2溶于水充分反应转移NA个电子
B. 标准状况下,2.24 L HF与1.6 g CH4分子所含电子数目均为NA
C. 50 g质量分数为46%的乙醇溶液中氢原子总数为6NA
D. 25 ℃时,1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中所含NH4+的数目均为2NA
【答案】C
【解析】
A、氯气与水的反应是可逆反应;
B、HF在标准状况下为液态;
C、50g质量分数为46%的乙醇溶液中,乙醇的质量为50g×46%=23g,水的质量为(50g—23g)=27g,溶液中氢原子为两者所含氢原子之和;
D、NH4+在溶液中水解。
A项、氯气与水的反应是可逆反应,标准状况下22.4 L Cl2不可能完全反应,转移的电子数小于NA,故A错误;
B项、HF在标准状况下为液态,故2.24LHF的物质的量不是0.1mol,所含电子数目不为NA,故B错误;
C项、50g质量分数为46%的乙醇溶液中,乙醇的质量为50g×46%=23g,水的质量为(50g—23g)=27g,溶液中氢原子的物质的量为(![]() ×6+
×6+![]() ×2)=6mol,溶液中氢原子总数为6NA,故C正确;
×2)=6mol,溶液中氢原子总数为6NA,故C正确;
D项、NH4+在溶液中水解,则1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中NH4+的物质的量均小于2mol,所含NH4+的数目均小于2NA,故D错误。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
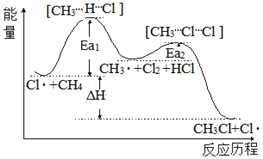
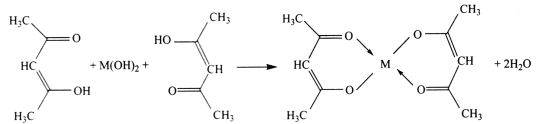
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
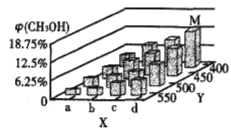
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
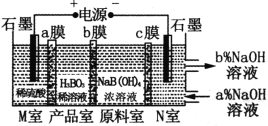
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
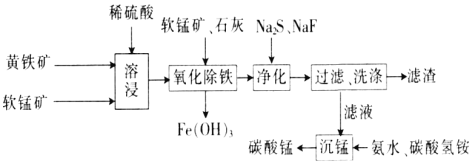
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛应用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:
已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:___________;浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿目的是______________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
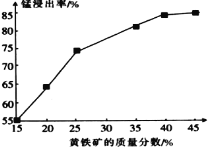
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。