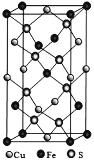
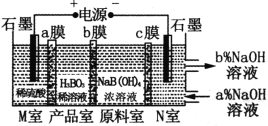
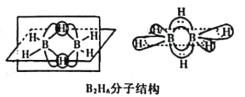
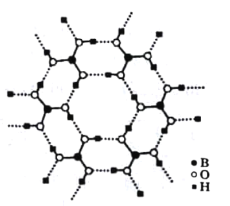
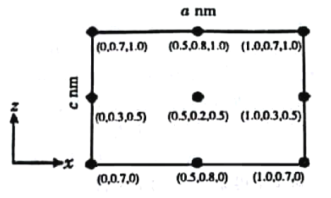
题目内容
【题目】下列应用与反应原理设计不一致的是( )
A.热的纯碱溶液清洗油污:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
B.明矾净水:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量) ![]() TiO2xH2O↓+4HCl
TiO2xH2O↓+4HCl
D.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2O![]() Sn(OH)Cl+HCl
Sn(OH)Cl+HCl
【答案】D
【解析】
A. 热的纯碱溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-,水解过程是吸热的过程,升高温度,可以促进盐的水解,所以热的纯碱溶液清洗油污,属于盐的水解原理的应用,故A不符合;
+OH-,水解过程是吸热的过程,升高温度,可以促进盐的水解,所以热的纯碱溶液清洗油污,属于盐的水解原理的应用,故A不符合;
B. 铝离子水解生成氢氧化铝胶体:Al3++3H2O![]() Al(OH)3+3H+,氢氧化铝胶体能吸附水中悬物并使之沉降,故明矾净水属于盐的水解原理的应用,故B不符合;
Al(OH)3+3H+,氢氧化铝胶体能吸附水中悬物并使之沉降,故明矾净水属于盐的水解原理的应用,故B不符合;
C. TiCl4水解可以得到TiO2xH2O,加热失去结晶水即可得到二氧化钛,故用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量) ![]() TiO2xH2O↓+4HCl,属于盐的水解原理的应用,故C不符合;
TiO2xH2O↓+4HCl,属于盐的水解原理的应用,故C不符合;
D. SnCl2溶液水解反应为:SnCl2+H2O![]() Sn(OH)Cl+HCl,故溶液呈酸性,可以加盐酸来抑制其水解,配制氯化亚锡溶液时加入氢氧化钠会促使平衡正向移动,不能制得氯化亚锡溶液,不属于盐的水解原理的应用,故D符合;
Sn(OH)Cl+HCl,故溶液呈酸性,可以加盐酸来抑制其水解,配制氯化亚锡溶液时加入氢氧化钠会促使平衡正向移动,不能制得氯化亚锡溶液,不属于盐的水解原理的应用,故D符合;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
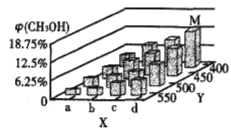
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ________________________________
(2)从开始至2min,Z的平均反应速率为 ________________
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ____________ 、 _______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 _________________ ,化学反应速率越大。