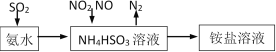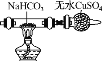题目内容
【题目】下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(![]() )与立方烷(
)与立方烷(![]() )的二氯代物数目相同
)的二氯代物数目相同
【答案】A
【解析】
A项、纤维素在一定条件下发生水解反应最终生成葡萄糖,花生油是油脂,在一定条件下发生水解反应生成高级脂肪酸(或盐)和甘油,蚕丝的主要成分是蛋白质,在一定条件下发生水解反应最终生成氨基酸,故A正确;
B项、煤的气化、液化是化学变化,故B错误;
C项、新戊烷用系统命名法命名为2,2—二甲基丙烷,故C错误;
D项、正四面体烷的二氯代物有1种,立方烷的二氯代物有3种,故D错误。
故选A。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
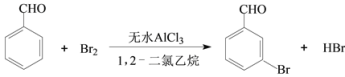
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
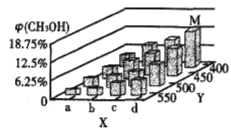
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D