题目内容
【题目】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第______族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是______(填元素符号、下同)、电负性最小的是______;其中阴离子的空间结构是______,C的杂化方式为______。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
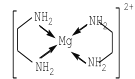
则该环状离子中镁离子的配位数为______。
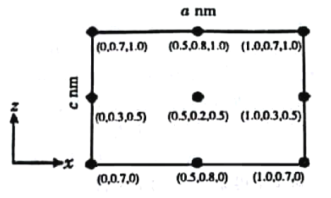
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:
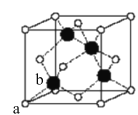
其晶胞棱长为δpm、则其密度为______g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为______pm(用含δ的代数式表示)。a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:______、______。(已知:1m=102cm=1012pm)
【答案】ⅠB N K 直线型 sp 4 ![]()
![]() δ (0,0,0) (
δ (0,0,0) (![]() ,
,![]() ,
,![]() )
)
【解析】
(1)根据题意分析电子排布、确定在周期表中的位置;
(2)在氰酸钾(KOCN)的组成元素中,C、N、O是同一周期的元素,N的2p能级是半充满状态,结构稳定,第一电离能最大;钾是金属,易失电子,吸电子能力最小,电负性最小;其中阴离子的空间结构是直线型,C的价层电子对为2+![]() =2,确定杂化方式;
=2,确定杂化方式;
(3)环状离子中镁离子与4个氮原子间形成4个配位键,以此确定配位数;
(4)根据均摊法先算出晶胞质量,用ρ=![]() 计算;四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向底面作垂线,构成直角三角形,两边分别为
计算;四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向底面作垂线,构成直角三角形,两边分别为![]() ,即可求出斜边为
,即可求出斜边为![]() pm,以a为原点,a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:(0,0,0);(
pm,以a为原点,a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:(0,0,0);(![]() ,
,![]() ,
,![]() )。
)。
(1)某二价金属离子有9个价电子,价电子的能级为3d,原子的价电子排布式为:3d104s1,为铜元素,位于周期表中的第四周期、第ⅠB族。故答案为:ⅠB;
(2)在氰酸钾(KOCN)的组成元素中,C、N、O是同一周期的元素,N的2p能级是半充满状态,结构稳定,第一电离能最大的是N;钾是金属,易失电子,吸电子能力最小,电负性最小的是K;其中阴离子的空间结构是直线型,C的价层电子对为2+![]() =2, C的杂化方式为sp。故答案为:N;K;直线型;sp;
=2, C的杂化方式为sp。故答案为:N;K;直线型;sp;
(3)环状离子中镁离子与4个氮原子间形成4个配位键,配位数为4。故答案为:4;
(4)晶胞中含有S2-位于顶点和面心,共含有8×![]() +6×
+6×![]() =4,Zn2+位于体内,共4个,则晶胞中平均含有4个ZnS,质量为
=4,Zn2+位于体内,共4个,则晶胞中平均含有4个ZnS,质量为![]() g,其晶胞棱长为δpm,体积为(δ×10-10)3cm3,其密度为
g,其晶胞棱长为δpm,体积为(δ×10-10)3cm3,其密度为![]() g/cm3;四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向底面作垂线构成直角三角形,两边分别为
g/cm3;四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向底面作垂线构成直角三角形,两边分别为![]() ,即可求出斜边为
,即可求出斜边为![]() pm(即位置a与位置b之间的距离),以a为原点,a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:(0,0,0);(
pm(即位置a与位置b之间的距离),以a为原点,a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:(0,0,0);(![]() ,
,![]() ,
,![]() )。故答案为:
)。故答案为:![]() ;
;![]() δ;(0,0,0);(
δ;(0,0,0);(![]() ,
,![]() ,
,![]() )。
)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=______kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
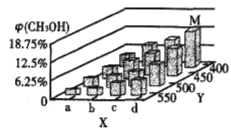
①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×107、K2=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
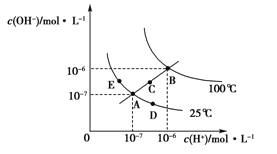
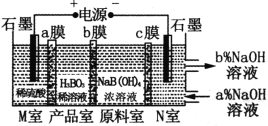
【题目】某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项 | A | B | C | D |
实验步骤 | 制备NH3 | 制备NaHCO3 | 分离NaHCO3 | 煅烧NaHCO3 |
实验装置 |
|
|
|
|
解释或说明 | 试剂X可选择NH4Cl | 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 | 该装置可用于分 离NaHCO3 | 无水CuSO4的作用是检验NaHCO3是否完全分解 |
A.AB.BC.CD.D
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ________________________________
(2)从开始至2min,Z的平均反应速率为 ________________
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ____________ 、 _______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 _________________ ,化学反应速率越大。