题目内容
2.某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下: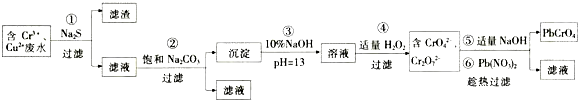
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH-=[Cr(OH)4]-
回答下列问题:
(1)滤渣的成分是CuS(填化学式);第②步加入Na2CO3溶液的作用是调节溶液的pH,使Cr3+完全沉淀为Cr(OH)3.
(2)第④步生成CrO42-的离子方程式为2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O.
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释:由于溶液中存在化学平衡:Cr2O72-+H2O?2CrO42-+2H+,当加入NaOH时,有利于平衡正向移动,故提高了铅铬黄的产率.
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L-1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、滴定管、锥形瓶,测定标准液体积的仪器事先进行洗涤所用试剂依次为自来水、蒸馏水、标准液;此铅铬黄样品的质量分数w=$\frac{323cV}{3000m}$(用含c、m和V的式子表示).
分析 含Cr3+、Cu2+废水,加Na2S,铜离子会生成CuS沉淀,过滤,滤渣为CuS,滤液中含有Cr3+,在滤液中加饱和的碳酸钠溶液调节pH,使Cr3+完全沉淀为Cr(OH)3沉淀,过滤,滤渣中加氢氧化钠溶液,再加适量的双氧水,生成含有CrO42-、Cr2O72-的溶液,然后加氢氧化钠和硝酸铅,生成铅铬黄,趁热过滤,得到铅铬黄;
(1)根据流程分析判断;溶液中加入Na2CO3可以消耗氢离子,调节pH;
(2)[Cr(OH)4]-与双氧水反应生成CrO42-;
(3)由于溶液中存在化学平衡:Cr2O72-+H2O?2CrO42-+2H+,根据平衡移动原理分析;
(4)滴定时用到的仪器有滴定管、锥形瓶、烧杯;根据洗涤仪器的操作分析;由2CrO42-+6I-+16H+=2Cr3++3I2+8H2O、I2+2S2O32-=2I-+S4O62- 可知,存在CrO42-~3S2O32-,以此计算,再求出质量和铅铬黄样品的质量分数.
解答 解:含Cr3+、Cu2+废水,加Na2S,铜离子会生成CuS沉淀,过滤,滤渣为CuS,滤液中含有Cr3+,在滤液中加饱和的碳酸钠溶液调节pH,使Cr3+完全沉淀为Cr(OH)3沉淀,过滤,滤渣中加氢氧化钠溶液,再加适量的双氧水,生成含有CrO42-、Cr2O72-的溶液,然后加氢氧化钠和硝酸铅,生成铅铬黄,趁热过滤,得到铅铬黄;
(1)根据流程分析可知滤渣的成分是CuS;溶液中加入Na2CO3可以消耗氢离子,调节pH,使Cr3+完全沉淀为Cr(OH)3;
故答案为:CuS;调节溶液的pH,使Cr3+完全沉淀为Cr(OH)3;
(2)[Cr(OH)4]-与双氧水反应生成CrO42-和水,则第④步生成CrO42-的离子方程式为2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O;
故答案为:2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O;
(3)由于溶液中存在化学平衡:Cr2O72-+H2O?2CrO42-+2H+,当加入NaOH时,氢氧化钠消耗氢离子,有利于平衡正向移动,故提高了铅铬黄的产率;
故答案为:由于溶液中存在化学平衡:Cr2O72-+H2O?2CrO42-+2H+,当加入NaOH时,有利于平衡正向移动,故提高了铅铬黄的产率;
(4)溶解固体一般在烧杯中进行,滴定时标准溶液盛放在碱式滴定管中,待测溶液盛放在锥形瓶中,所以实验中用到的仪器有滴定管、锥形瓶、烧杯;
测定标准液体积的仪器事先进行洗涤,洗涤的方法为先用自来水洗,再用蒸馏水洗最后用待装溶液洗,则所用试剂依次为自来水、蒸馏水、标准液;
由2CrO42-+6I-+16H+=2Cr3++3I2+8H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在:CrO42-~3S2O32-,
1 3
n c mol•L-1×V×10-3L
则n=$\frac{1}{3}$×c mol•L-1×V×10-3L,
则m(PbCrO4)=nM=$\frac{1}{3}$×c mol•L-1×V×10-3L×323g/mol,
所以铅铬黄样品的质量分数w=$\frac{\frac{1}{3}×cmol•{L}^{-1}×V×1{0}^{-3}L×323g/mol}{mg}$=$\frac{323cV}{3000m}$;
故答案为:滴定管、锥形瓶;自来水、蒸馏水、标准液;$\frac{323cV}{3000m}$.
点评 本题考查制备实验方案的设计,把握制备流程中混合物分离提纯、除杂及发生的反应为解答的关键,侧重分析能力、实验能力、推断及计算能力的综合考查,题目难度中等.

4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.06 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
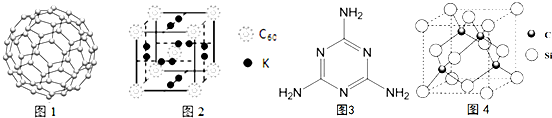
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
(1)单质中氧化性最强的是F2,其电子式是
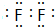 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是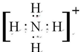 .
.(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
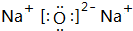 ,
,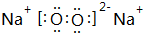 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移. | A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |