题目内容
12.在一定条件下,某密闭容器中进行反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.06 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
分析 v(NH3)=$\frac{△c}{△t}$=$\frac{1.0-0.2}{20}$mol/(L.s)=0.04mol(L.s),同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,据此计算水的反应速率.
解答 解:v(NH3)=$\frac{△c}{△t}$=$\frac{1.0-0.2}{20}$mol/(L.s)=0.04mol(L.s),同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以在这20s内H2O的化学反应速率=$\frac{6}{4}$v(NH3)=$\frac{6}{4}$×0.04mol(L.s)=0.06 mol/(L•s),故选B.
点评 本题考查反应速率有关计算,明确反应速率与计量数关系是解本题关键,熟悉反应速率基本公式,题目难度不大.

练习册系列答案
相关题目
2.以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO为原料,可以制取氧化锌和金属锌)
Ⅰ、制取氯化锌主要工艺如图:
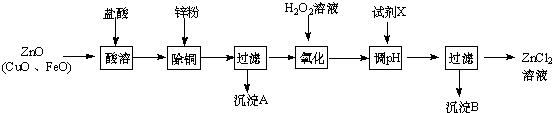
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)加入H2O2溶液发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)流程图中,为了降低溶液的酸度,试剂X不可以是d(选填序号);pH应调整到3.2≤pH<5.2
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.
(4)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-;.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
Ⅰ、制取氯化锌主要工艺如图:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)流程图中,为了降低溶液的酸度,试剂X不可以是d(选填序号);pH应调整到3.2≤pH<5.2
a.ZnO b.Zn(OH)2 c.Zn2(OH)2CO3 d.ZnSO4
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.
(4)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-;.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
7.下列说法正确的是( )
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
17.有关2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3的说法中,不正确的是( )
| A. | 该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 | |
| B. | 达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 | |
| D. | 平衡时SO2、O2、SO3的分子数之比不再改变 |
4.下列实验操作不能实现实验目的是( )
| 操作 | 目的 | |
| A | 食醋浸泡水垢 | 比较乙酸和碳酸的酸性强弱 |
| B | 向蔗糖溶液中加入稀硫酸,水浴加热,5min后向其中加入新制Cu(OH)2的悬浊液,加热. | 证明蔗糖水解产物中有葡萄糖 |
| C | 向NaBr溶液中加入少量氯水,振荡后加入少量四氯化碳,振荡,静置. | 比较氯、溴非金属性强弱 |
| D | 钠分别与水和乙醇反应 | 乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
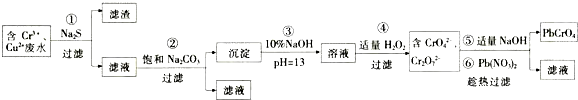
 碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.
碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.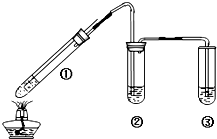 某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.