题目内容
9.25℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸中和氢氧化钠的物质的量相同 |
分析 A.根据碳酸钠溶液中的物料守恒判断;
B.铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-),由于铵根离子的水解程度减小,则c(NH4+)>c(SO42-);
C.根据醋酸钠溶液中的电荷守恒分析;
D.醋酸为弱酸,等体积、等pH的两溶液中,醋酸的物质的量大于盐酸,则醋酸消耗的氢氧化钠的物质的量多.
解答 解:A.饱和纯碱(Na2CO3)溶液中,根据物料守恒可得:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A错误;
B.1mol/L的(NH4)2SO4溶液中,NH4+部分水解,溶液显示酸性,则:c(H+)>c(OH-),由于NH4+的水解程度减小,则c(NH4+)>c(SO42-),溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故B正确;
C.0.10mol/L醋酸钠溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D.等体积、pH=3的盐酸和醋酸中,由于醋酸为弱电解质,在溶液中部分电离出氢离子,则醋酸的浓度大于盐酸,两溶液在醋酸的物质的量大于盐酸,故中和氢氧化钠的物质的量不相等,故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,D为易错点,注意弱电解质在溶液中存在电离平衡,试题充分考查了学生灵活应用基础知识的能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
19.根据下列各物质的物理性质,判断其固态肯定不属于分子晶体的是( )
| A. | 溴化铝(无色晶体,熔点98℃,熔融态不导电) | |
| B. | 碳化铝(黄色晶体,熔点2200℃,熔融态不导电) | |
| C. | 氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力) | |
| D. | 五氟化钒(无色晶体,熔点19.5℃,易溶于乙醇) |
20.下列说法不正确的是( )
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| C. | 分光光度计不能用于测定草酸与高锰酸钾的反应速率 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
17.A、B、C、D四种元素在周期表中分别处于元素X的四周(如图)已知元素X最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族元素中最小的.
(1)写出各元素的符号:ASiBNCSDAs.
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为H2SO4>H3PO4>H3AsO4.
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为NH3>PH3>SiH4.
| B | ||
| A | X | C |
| D |
(2)写出C、D、X气态氢化物最高价氧化物对应水化物的化学式,其酸性由强到弱的顺序为H2SO4>H3PO4>H3AsO4.
(3)写出A、B、X气态氢化物的化学式,其稳定性由强到弱的顺序为NH3>PH3>SiH4.
1.化学中很多规律(性质)都有其适用范围,下列根据其推出的结论正确的是( )
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
18.阿司匹林是用苯酚等原料合成的,而苯酚是用一氯取代物氯苯为原料制造的.其反应的方程式如下: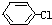 +NaOH→
+NaOH→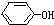 +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )
 +NaOH→
+NaOH→ +NaCl,该反应的反应类型属于( )
+NaCl,该反应的反应类型属于( )| A. | 加成反应 | B. | 取代反应 | C. | 氧化还原反应 | D. | 置换反应 |
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$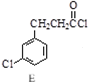 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$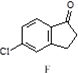
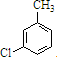 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.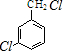 +3NaOH$→_{催化剂}^{高温、高压}$
+3NaOH$→_{催化剂}^{高温、高压}$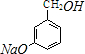 +2NaCl+H2O.
+2NaCl+H2O. (任写一种).
(任写一种). .
.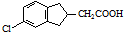 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: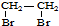
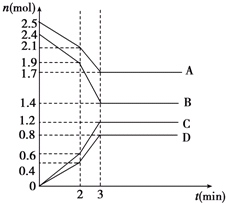 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题: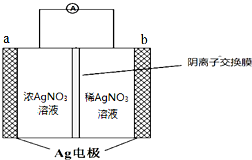 银是一种在工业、生活上有广泛用途的金属.
银是一种在工业、生活上有广泛用途的金属.