题目内容
19.根据下列各物质的物理性质,判断其固态肯定不属于分子晶体的是( )| A. | 溴化铝(无色晶体,熔点98℃,熔融态不导电) | |
| B. | 碳化铝(黄色晶体,熔点2200℃,熔融态不导电) | |
| C. | 氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力) | |
| D. | 五氟化钒(无色晶体,熔点19.5℃,易溶于乙醇) |
分析 A.熔沸点较低,液体不导电,则构成微粒为分子;
B.熔点高不是分子晶体的性质;
C.熔融时或溶于水时破坏了相同的作用力,说明形成的是离子键;
D.熔沸点较低,易溶于有机溶剂.
解答 解:A.溴化铝,无色晶体,熔点98℃,熔融态不导电,具有分子晶体的性质,属于分子晶体,故A不选;
B.碳化铝,黄色晶体,熔点2200℃,熔融态不导电,应为原子晶体,故B选;
C.氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力),说明破坏的是离子键,应为离子化合物,故C选;
D.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇中,具有分子晶体的性质,属于分子晶体,故D不选;
故选BC.
点评 本题考查原子晶体、分子晶体、离子晶体的性质,熟悉熔沸点及构成微粒是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2和O3互为同位素 | |
| C. | CH3-CH2-CH2-CH3与 互为同系物 互为同系物 | |
| D. |  与 与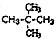 互为同分异构体 互为同分异构体 |
14.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
11.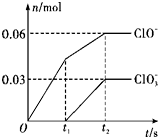 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | 反应中转移电子数为是0.42 NA | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3 mol | |
| D. | 生成物中Cl-的物质的量为0.21 mol |
8.下列物质属于电解质的是( )
| A. | 氧气 | B. | 氯化氢 | C. | 二氧化硫 | D. | 铜 |
9.25℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸中和氢氧化钠的物质的量相同 |

 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题: .
.